Du er her
Psykologisk behandling av ikke-motoriske symptomer ved Parkinsons sykdom
Søvnforstyrrelser og psykiske plager som angst og depresjon er vanlig ved Parkinsons sykdom. Både farmakologiske og psykologiske intervensjoner kan være til hjelp.
For omtrent 200 år siden publiserte James Parkinson kasusstudien «An essay on the shaking palsy». Essayet fra 1817 var den første systematiske beskrivelsen av det som i dag er kjent som Parkinsons sykdom. Siden da har forskning gitt oss en grundig beskrivelse av sykdommens epidemiologi og klinikk, mens etiologien fremdeles er ukjent. Parkinson er den nest vanligste nevrodegenerative lidelsen etter Alzheimers sykdom, med en estimert prevalens på 1 prosent hos personer over 60 år (Pringsheim, Jette, Frolkis, & Steeves, 2014). Parkinsons sykdom kjennetegnes primært av tap av dopaminproduserende celler i substantia nigra og funn av lewylegemer (patologiske strukturer av sammenfoldet protein i hjernen). Disse kan sees i gjenværende nevroner i ulike deler av sentralnervesystemet. Tap av dopamin i hjernen, og endringer i andre nevrotransmittere, gir opphav til motoriske symptomer, som hviletremor, rigiditet, bradykinesi (motorisk treghet) og postural instabilitet (ustabilitet mens stående), og en rekke ikke-motoriske plager. Blant de mest utbredte ikke-motoriske symptomene finner man søvnforstyrrelser og psykiske plager som depresjon, angst og impulskontrollforstyrrelser. Disse symptomene kan ha negativ innvirkning på pasientenes livskvalitet og gir ofte hjelpebehov ut over det som tilbys av tradisjonelle nevrologiske poliklinikker. På grunn av den store aldersspredningen blant pasienter med sykdommen vil pasienter komme i kontakt med psykologer i store deler av hjelpeapparatet: somatiske avdelinger, alderspsykiatriske poliklinikker, distriktspsykiatriske poliklinikker, privat praksis og førstelinjetjenesten. I denne artikkelen illustrerer vi gjennom tre kliniske vignetter noen typiske ikke-motoriske symptomer ved tilstanden. Vi vil gi en oppdatert oppsummering av forskningsfeltet og relevante behandlingstilnærminger for depresjon og angst, impulskontrollforstyrrelser og søvnforstyrrelser hos pasienter med Parkinsons sykdom. Av plasshensyn vil ikke hallusinasjoner, psykose, smerte, mild kognitiv svikt og demens dekkes i denne gjennomgangen, til tross for at disse plagene også er utbredt blant pasienter med lidelsen. Det bemerkes at de kliniske vignettene som blir presentert, er fiktive og laget for å illustrere en typisk klinisk presentasjon av denne type symptomer hos personer med Parkinsons sykdom.
Depresjon og angst
En 55 år gammel mann med Parkinsons sykdom henvises til allmennpoliklinikk for depressive plager og symptomer på angst av sin fastlege. Kjent Parkinson de siste tre år, med god respons på dopaminerg medisinering. Pasienten har hatt det tøft det siste året, med flere sykemeldinger fra jobb. Pasienten opplever vansker med indre uro, konsentrasjon, redusert appetitt, svekkede følelsesmessige reaksjoner og lite initiativ (MADRS = 18). Fastlegen noterer at pasienten ikke rapporterer depressivt tankeinnhold, men bruker mye tid på å bekymre seg. Pasienten fremstår emosjonelt avflatet og mimikkfattig, men samarbeider og kommuniserer adekvat, dog med noe latens. Samtale og screening med MoCA ga ingen holdepunkter for vesentlig kognitiv svikt. I inntaksteamet ved allmennpoliklinikken er det noe uenighet om hvorvidt pasientens symptomatologi er et resultat av Parkinson alene, og hvorvidt pasientens symptomer tilfredsstiller kriteriet om alvorlighet.
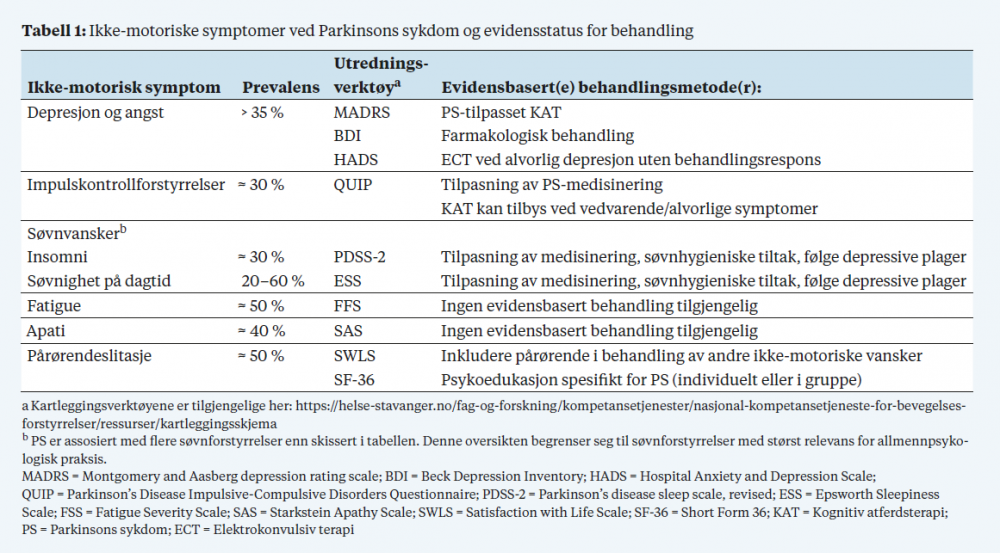
Depressive symptomer er vanligere hos pasienter med Parkinson enn hos jevnaldrende i den generelle befolkningen (Årsland, Pahlhagen, Ballard, Ehrt, & Svenningsson, 2011). Omtrent 35 % av pasientene rapporterer klinisk relevante depressive symptomer (Reijnders, Ehrt, Weber, Årsland, & Leentjens, 2008). Milde og moderate depressive vansker er mest utbredt (22 %), mens alvorlig depressiv lidelse (17 %) og dystymi (13 %) også kan forekomme. Som i befolkningen ellers er depressive symptomer knyttet til redusert livskvalitet og psykososial fungering også hos pasienter med Parkinsons, og studier har vist at deprimerte pasienter kan ha raskere utvikling av motoriske symptomer (Carod-Artal, Ziomkowski, Mourao Mesquita, & Martinez-Martin, 2008). Parkinson-assosiert depresjon (PSd) ledsages ofte av angstplager, som regel i form av generalisert angst, panikkangst eller sosial fobi.
Parkinson-assosiert depresjon kan lett overses i klinisk praksis grunnet stor symptomatisk overlapp mellom depresjon, angst og symptomer på Parkinsons sykdom (redusert appetitt, forstyrret søvn, bradyfreni og nedsatt mimikk, for å nevne noen). Konsentrasjonsvansker, uoppmerksomhet og beslutningsvegring kan også opptre hos parkinsonpasienter uten depressive vansker. Angstplager fluktuerer ofte med motorisk funksjonsevne og dagsvariasjon i effekten av parkinsonmedisiner (såkalte on- og off-perioder). I så måte er det umulig å utelukke organisk årsaksforhold for denne type plager ved Parkinson, og det anbefales at en i klinisk praksis har en «inkluderende» tilnærming til symptomene og unngår å forsøke å skille mellom «primære» og «sekundære» symptomer (Leentjens et al., 2008; Marsh et al., 2006). Depresjon hos pasienter med Parkinson forstås i så måte best ut fra en biopsykososial modell, der de nevrodegenerative aspektene ved PS vektes i særlig grad. Videre anbefales det å bruke Parkinsons-spesifikke cut off-verdier ved bruk av typiske screeningverktøy, som MADRS (total skåre > 14) og HAMD (total skåre > 13).
Depresjon vil ofte ledsages av to andre nevropsykiatriske tilstander: fatigue og apati. Fatigue kjennetegnes av en overveldende følelse av trøtthet, energimangel eller utmattelse. Tilstanden oppstår hos omtrent halvparten av pasienter med Parkinsons sykdom, oftest hos pasienter med depressive plager, søvnvansker, apati og kognitive vansker (Kluger et al., 2017). Apati er en tilstand preget av motivasjonssvikt og oppstår hos omtrent 40 % av pasientene med sykdommen (den Brok et al., 2015). Sentrale symptomer inkluderer redusert evne til å ta initiativ, vise interesse for omgivelsene eller for å lære seg noe nytt, eller fremvise følelsesmessige reaksjoner (Pedersen, Larsen, Alves, & Årsland, 2009). Apati oppstår oftere hos eldre pasienter og ved ulike demenstilstander, og gjerne samtidig med milde depressive plager. Både fatigue og apati regnes som vedvarende nevropsykiatriske plager ved lidelsen, og det finnes i dag ingen behandlinger med overbevisende effekt for disse plagene. Det er derfor viktig å kartlegge både fatigue og apati både før og etter et behandlingsforløp, ettersom disse tilstandene kan vedvare til tross for at en pasients depressive plager er blitt bedre.
Psykoterapi for Parkinson-assosiert depresjon
Om pasienten som ble henvist for depresjon og angst, kan vi lese følgende i journalen:
Pasienten tilbys en vurderingssamtale ved poliklinikken. Under samtalen vurderes han å tilfredsstille kriteriene for en depressiv episode, og pasienten gis et tilbud om behandling. Under kartleggingen viser pasienten også symptomer på apati, men det er uklart om dette er en del av pasientens depressive tilstand eller ei. Etter en konsultasjon med pasientens nevrolog fremgår det at pasienten har hatt symptomer på apati i flere år, men at de depressive symptomene er nye. Ettersom pasientens plager fremstår som milde, tilbys han kognitiv atferdsterapi (KAT) som er tilpasset pasienter med Parkinson-assosiert depresjon, som førstelinjebehandling. Eventuell farmakologisk behandling vil vurderes om symptomene vedvarer etter psykoterapi.
Ikke-medikamentelle behandlingsformer, som psykoterapi, er generelt lite studert ved Parkinsons sykdom, men flere kasuistikker og ikke-randomiserte studier har vist at psykoterapi kan egne seg for pasienter med Parkinson-assosiert depresjon. Kun et fåtall randomiserte kontrollerte studier av psykoterapi for depresjon er gjennomført hos denne pasientgruppen, og da i hovedsak på KAT. Disse studiene tyder på at KAT kan gi betydelig reduksjon i alvorlighet av plager og kan gi symptomlette ved tilstanden (Calleo et al., 2015; Dobkin et al., 2011). Samtidig varierer disse studiene i utfallsmål, inklusjons- og eksklusjonskriterier, størrelse og varighet. For eksempel er det uklart hvorvidt KAT gir vedvarende behandlingseffekt etter én måned. Samlet er evidensen for KAT ved Parkinson-assosiert depresjon svak og av varierende kvalitet. Det er derfor stort behov for nye randomiserte kontrollerte studier, og da gjerne studier av nyere behandlingsformer som mindfulness-basert kognitiv terapi og metakognitiv terapi.
De siste årene har den psykologiske fenomenologien knyttet til Parkinson-assosiert depresjon blitt beskrevet i større detalj, noe som gjør at vi i dag anbefaler at KAT tilpasses de særegne utfordringene en ser blant pasienter med denne tilstanden (Calleo et al., 2015; Dobkin, Menza, & Bienfait, 2008; Egan, Laidlaw, & Starkstein, 2015). Pasienter med Parkinson-assosiert depresjon og angstplager har en økt tendens til både atferdsmessig og kognitiv unngåelse (Evans & Norman, 2009; Hurt et al., 2011). Økt ruminering og høyt sykdomsfokus, spesielt på de motoriske symptomene ved sykdommen, er også beskrevet hos disse pasientene (Julien, Rimes, & Brown, 2016). Kliniske observasjoner tyder på at pasienter med angstplager også kan ha innslag av somatisering, uten at denne observasjonen er etablert empirisk.

Noen sentrale anbefalinger for KAT for Parkinson-assosiert depresjon er presentert i tabell 2. Som ved all KAT er en kasusformulering, der pasientens symptomer, kjerneantakelser og handlinger settes i system og gir grunnlag for behandlingsmål, sentral også ved denne formen for depresjon (for et godt eksempel på kasusformulering for pasienter med Parkinson-assosiert depresjon, se Egan og medarbeidere, 2015). Tema knyttet til unngåelse og sosial isolasjon, somatisk fokus, ruminering håndtering av stress og angst, monitorering av motoriske symptomer og søvnhygiene fremstår som viktig for pasienter med Parkinson, mens tradisjonelle depressive symptomer som selvbebreidelse, nedsatt selvfølelse og tristhet ofte er mindre fremtredende. Sentralt i behandlingen er atferdsaktivisering (gjerne i form av fysisk aktivitet / trening), tankeregistrering, atferdseksperimenter, oppmerksomhetstrening og avslapningsøvelser.
Merk at kognitiv funksjon bør evalueres hos alle pasienter med Parkinsons sykdom, ettersom mild kognitiv svikt er hyppig forekommende, og flertallet av pasienter utvikler demens i sene stadier av Parkinson. De fleste studier av KAT for Parkinson-assosiert depresjon har også ekskludert pasienter med indikasjon på kognitiv svikt (MoCA skåre ≤ 25; MMSE skåre ≤ 24), noe som gjør evidensgrunnlaget dårligere for denne gruppen. Samtidig tyder kliniske erfaringer på at samtaleterapi kan tilpasses de ekstra utfordringene som oppstår ved mild kognitiv svikt: Terapeuten kan repetere nøkkelpoeng, ha kortere timer, oppsummere skriftlig, tilpasse skriftlig materiale for hjemmelekser og bruke kalender og påminnere (Dobkin et al., 2008).
Impulskontrollforstyrrelser
Psykolog ved somatisk avdeling kontaktes for å ha konsultasjon med en 53 år gammel mann med Parkinson ved nevrologisk poliklinikk. Med bakgrunn i bekymringsmeldinger fra pasientens pårørende mistenker behandlende nevrolog at pasienten har utviklet impulskontrollforstyrrelse eller kognitiv svikt. Pasienten har i den senere tid fremstått mer kaotisk, disinhibert og mindre bluferdig enn tidligere, og pårørende rapporterer at pasienten ikke lenger har orden på leiligheten sin. Pårørende mistenker at han har mistet kontroll over pengebruken, og forteller at pasienten er blitt overdrevent åpen og opptatt av sitt seksuelle liv, noe som er veldig utypisk for ham.
Impulskontrollforstyrrelser (IKF) oppstår hos 7–30 % av pasientene med Parkinson og er spesielt knyttet til bruk av dopaminerge medisiner, særlig dopaminagonister (Molde et al., 2018; Weintraub et al., 2010). Impulskontrollforstyrrelser inkluderer impulsive og kompulsive atferdsforstyrrelser, som pengespillavhengighet, hyperseksualitet, overspising og økt kjøpetrang. I tillegg er hobbyisme (overdreven tidsbruk på en hobby), punding (stereotyp, gjentakende atferd) og kompulsiv vandring også utbredt. Forstyrrelsene kan potensielt få alvorlige juridiske og/eller økonomiske konsekvenser og kan være vanskelige å oppdage i klinisk praksis ettersom pasientene ofte ikke rapporterer om slike symptomer spontant eller ikke opplever atferden som problematisk. Selv om disse forstyrrelsene er sterkt knyttet til bruk av dopaminerg medisinering, utvikler langt ifra alle som bruker slike medisiner, symptomer, noe som taler for en underliggende sårbarhet hos den enkelte. Risikofaktorer inkluderer ung alder, impulsive personlighetstrekk, familiehistorikk med avhengighet og genetiske forhold (Erga et al., 2018; Voon et al., 2011). Impulskontrollforstyrrelser er også blitt assosiert med økte depressive plager, men ser ikke ut til å være knyttet til mild kognitiv svikt eller demensutvikling (Erga, Alves, Larsen, Tysnes, & Pedersen, 2017). Pasienter med denne typen forstyrrelser kan vise spesifikke kognitive dysfunksjoner knyttet til abstraksjon, kognitiv fleksibilitet, visuospatial fungering og beslutningstaking (Santangelo, Raimo, & Barone, 2017).
Etter undersøkelse av pasient henvist for differensialdiagnostisk vurdering av impulskontrollforstyrrelser eller kognitiv svikt noterer behandlingsansvarlig følgende i journalen: Etter kognitiv testing, klinisk intervju og en tverrfaglig diskusjon vurderes pasienten som kognitivt intakt, men med symptomer forenelig med impulskontrollforstyrrelse, da i form av hyperseksualitet og kompulsiv shopping. For å redusere denne atferden forsøkes det å optimalisere den dopaminerge medisineringen. Ved kontroll forteller pasienten at atferden ikke lenger er noe problem, men bekymringsmeldinger fra pårørende og førstelinjetjenesten tyder på at pasientens vansker er vedvarende, og de stiller spørsmål ved pasientens evne til å bo alene.
Førstelinjebehandling ved impulskontrollforstyrrelser er å tilpasse medisinbruken, og da spesielt redusere bruken av dopaminagonister. Endring av dopaminerge medisiner er imidlertid ikke noe alternativ for alle pasienter, ettersom endringer kan føre til forverring av motoriske symptomer og gir risiko for utvikling av «dopamine agonists withdrawal syndrome» (Voon et al., 2017). På grunn av dette har det vært forsøkt å identifisere behandlingsalternativer for pasienter med impulskontrollforstyrrelser. Enkeltstudier har vist at farmakologisk behandling med SSRI, amantadin og naltrekson kan redusere alvorlighetsgraden av forstyrrelsene, men større studier er nødvendig før kliniske anbefalinger kan gis (Voon et al., 2017). KAT har også vist lovende resultater i en mindre pilotstudie (N = 45) og kan gi signifikant reduksjon i alvorlighetsgraden av impulskontrollforstyrrelser (Okai et al., 2013). KAT inkluderer ved denne typen tilstander motiverende intervjuteknikker, ettersom impulskontrollforstyrrelser ikke alltid oppleves som en belastning for den berørte pasienten (se Okai og medarbeidere, 2013 for mer detaljer om KAT-manualen). Samtidig ser det ut til at pasienter med høy alvorlighetsgrad (flere samtidige impulskontrollforstyrrelser, høy grad av angst eller depresjon) responderer dårligere på behandlingen enn pasienter med mindre alvorlige impulskontrollforstyrrelser, og effekten av KAT er sannsynligvis avhengig av optimalisert dopaminerg behandling (Okai, Askey-Jones, Samuel, David, & Brown, 2015). Impulskontrollforstyrrelser er i flere studier blitt assosiert med depressive symptomer, så det anbefales å inkludere depresjon og angstplager under utredning. Det er fremdeles mye usikkerhet rundt behandlingsalternativer for impulskontrollforstyrrelser, men siden konsekvensene av disse forstyrrelsene kan være alvorlige, er det naturlig å forsøke å begrense dem. KAT kan i så måte vurderes for pasienter som ikke har mulighet for å endre dopaminerge medisiner, eller hos pasienter som har vedvarende alvorlige symptomer til tross for optimalisert medisinering. Videre kan det være viktig med et tverrfaglig samarbeid mellom spesialisthelsetjenesten og førstelinjetjenesten, gjerne med bruk av individuell plan, for pasienter med de mest alvorlige impulskontrollforstyrrelsene.
Søvnforstyrrelser
En 60 år gammel kvinne med kjent Parkinson oppsøker kommunepsykolog etter å ha lest om tilbudet hos sin fastlege. Pasienten har hatt vansker med innsovning i lengre tid og har vært plaget med hyppige oppvåkninger om natten samt dårlig søvnkvalitet. Føler seg ofte stivere motorisk dagen etter dårlig søvn. Under innkomstsamtalen forteller pasienten om flere depressive symptomer, noe kartlegging med MADRS også bekrefter (MADRS = 16). Pasientens søvnvansker synes forenelig med insomni. Pasienten bruker flere ulike medikamenter, inkludert dopaminagonister, antidepressiva og medisin for innsovning. Etter tverrfaglig møte med behandlende nevrolog og gjennomgang av medisinliste legges en behandlingsplan der dopaminagonist nedjusteres, innsovningsmedisin seponeres og pasienten tilbys oppfølging av psykolog både for å følge utviklingen av depressive vansker og avhjelpe disse.
Søvnforstyrrelser forekommer vesentlig hyppigere hos pasienter med Parkinson enn hos jevnaldrende friske personer. Disse forstyrrelsene kan være et resultat av dopaminerg behandling eller Parkinson-spesifikk patologi, og de kan også oppstå i forbindelse med andre påkjenninger som stress. Vanlige søvnforstyrrelser ved Parkinsons sykdom inkluderer motorisk uro, søvnapné, nattlige hallusinasjoner, insomni, hypersomni og REM-søvnatferdsforstyrrelse. To av disse – insomni (redusert nattlig søvnkvalitet som fører til redusert funksjonsnivå på dagtid) og økt søvnighet på dagtid (på engelsk forkortet EDS) – er de hyppigst forekommende og mest invalidiserende søvnforstyrrelsene ved sykdommen.
Insomni er hyppig forekommende, og ca. 60 % rapporterer symptomer på insomni ved sene stadier av sykdommen. Typiske symptomer inkluderer søvnfragmentering, tidlig morgenoppvåkning og delvis sen innsovning. Selv om insomni ikke behøver å være vedvarende, er symptomene som regel behandlingskrevende idet de bidrar vesentlig til redusert livskvalitet (Gjerstad, Wentzel-Larsen, Årsland, & Larsen, 2007). Insomni kan også oppstå som en del av andre komorbide lidelser, som depresjon eller nokturi (vannlating om natten), samt oppstå som en komplikasjon av medikamentbruk (Tholfsen, Larsen, Schulz, Tysnes, & Gjerstad, 2015). Gjennomgang av medisinliste er derfor alltid anbefalt for denne pasientgruppen, noe som også understreker behovet for tverrfaglig samarbeid i både vurdering og behandling av denne typen symptomer.
Økt søvnighet på dagtid, som kjennetegnes av uønskede og tidvis imperative søvnanfall, opptrer hos omtrent 12 % av parkinsonpasienter før igangsetting av medisinering, og kjente risikofaktorer er økt premorbid søvnighet og bruk av dopaminagonister. Forekomsten av økt søvnighet på dagtid øker med alder og graden av sykdom, og omtrent 23 % har disse vanskene etter fem års sykdom (Gjerstad, Alves, Wentzel-Larsen, Årsland, & Larsen, 2015; Tholfsen et al., 2015).
Til tross for at det kun foreligger et fåtall pilotstudier som undersøker KAT for søvnforstyrrelse ved Parkinsons sykdom (Patel et al., 2017), gir funn fra den generelle befolkningen og fra pasienter med Alzheimers sykdom grunnlag for optimisme. Essensielt for samtlige søvnforstyrrelser er gjennomgang og optimalisering av medisinbruk og søvnhygieniske tiltak (Videnovic, 2017). Gode søvnhygieniske tiltak kan være: faste rutiner for når man står opp, holde høy aktivitet på dagen, avstå fra småhviler i løpet av dagen og eksponering for dagslys på dagen. Ved tidlig morgenoppvåkning må det utredes om plagene er en del av insomni eller fremskyndet søvnfase-syndrom, der pasienten sovner for tidlig om kvelden. Klinisk er det viktig å huske at søvnforstyrrelser kan oppstå ved andre psykiske vansker ved Parkinson, og behandling av for eksempel depressive vansker bør fortrinnsvis inkludere tiltak for søvnhygiene og søvnmonitorering hvis søvnvansker er en del av depresjonen. Det er også viktig å merke seg at depressive vansker ofte letter ved bruk av dopaminagonister, og dermed må følges tett opp ved seponering/justering av dose av denne medisinen.
Pårørendes plass i behandlingen
Parkinsons sykdom påvirker ikke bare pasienten selv, men har konsekvenser også for de pårørende. Pasienter med PS får over tid behov for mer assistanse og stell etter som sykdommen progredierer, og kan trenge hjelp av pårørende opp til 30 ganger per dag i de senere stadiene av sykdommen (Secker & Brown, 2005). I tillegg til et høyt omsorgsbehov og antall timer brukt på stell vil psykiske symptomer gi økt belastning for pårørende (Leiknes, Tysnes, Årsland, & Larsen, 2010). Vår kliniske erfaring tilsier at pårørende bør tilbys hjelp til å mestre både de praktiske, fysiske og psykiske utfordringene knyttet til Parkinson. Pårørende bør inkluderes under behandling, ettersom de ofte er en ressurs og noen ganger er helt sentrale for at pasienten skal få gjennomført sine dagligdagse gjøremål. I tillegg trenger pårørende ofte egne tiltak for å oppleve økt mestring i sin omsorgsrolle, redusere belastning og øke egen livskvalitet. Pårørendesentrerte intervensjoner er generelt lite undersøkt ved PS (Secker & Brown, 2005), men erfaringer fra andre kroniske lidelser tyder på at både individ- og grupperettede tiltak kan gi positive effekter på pårørendes mestring av stress og rollen som pårørende. Strukturerte psykoedukative grupper, som eksempelvis programmet Patient Education Program Parkinson, kan også virke forbyggende mot pårørendebelastning (A’Campo, Spliethoff-Kamminga, Macht, EduPark, & Roos, 2010).
Konklusjon
Pasienter med Parkinsons sykdom har høy risiko for å utvikle ikke-motoriske problemer som medfører negative konsekvenser for både pasient og pårørende. Behandling av vanskene krever tverrfaglig samarbeid. Pasienter med depresjon og angst kan dra nytte av både farmakologiske intervensjoner og psykologisk behandling i form av KAT. For andre ikke-motoriske symptomer som impulskontrollforstyrrelser og søvnvansker viser enkelte studier noe effekt av KAT. Både impulskontrollforstyrrelser og søvnvansker henger ofte sammen med den medikamentelle behandlingen for Parkinson. Det er derfor viktig at psykolog og behandlende nevrolog samarbeider tett om disse pasientene. Noen ikke-motoriske symptomer, som apati og fatigue, har ingen etablert evidensbasert behandling og vil ofte vedvare til tross for bedring av for eksempel depressive symptomer. Pårørende bør involveres i den psykologiske behandling av ikke-motoriske symptomer ved Parkinsons sykdom.
A'Campo, L.E., Spliethoff-Kamminga, N.G., Macht, M., EduPark, C., & Roos, R.A. (2010). Caregiver education in Parkinson's disease: formative evaluation of a standardized program in seven European countries. Quality of Life Research, 19(1), 55–64. doi:10.1007/s11136-009-9559-y
Calleo, J.S., Amspoker, A.B., Sarwar, A.I., Kunik, M.E., Jankovic, J., Marsh, L., … Stanley, M.A. (2015). A Pilot Study of a Cognitive-Behavioral Treatment for Anxiety and Depression in Patients With Parkinson Disease. Journal of Geriatric Psychiatry and Neurology, 28(3), 210–217. doi:10.1177/0891988715588831
Carod-Artal, F.J., Ziomkowski, S., Mourao Mesquita, H., & Martinez-Martin, P. (2008). Anxiety and depression: main determinants of health-related quality of life in Brazilian patients with Parkinson's disease. Parkinsonism and Related Disorders, 14(2), 102–108. doi:10.1016/j.parkreldis.2007.06.011
den Brok, M.G., van Dalen, J.W., van Gool, W.A., Moll van Charante, E.P., de Bie, R.M., & Richard, E. (2015). Apathy in Parkinson's disease: A systematic review and meta-analysis. Movement Disorders, 30(6), 759–769. doi:10.1002/mds.26208
Dobkin, R.D., Menza, M., Allen, L.A., Gara, M.A., Mark, M.H., Tiu, J., … Friedman, J. (2011). Cognitive-Behavioral Therapy for Depression in Parkinson’s Disease: A Randomized, Controlled Trial. American Journal of Psychiatry, 168, 1066–1074.
Dobkin, R.D., Menza, M., & Bienfait, K.L. (2008). CBT for the treatment of depression in Parkinson’s disease: a promising nonpharmacological approach. Expert Reviews of Neurotherapeutics, 8(1), 27–35.
Egan, S.J., Laidlaw, K., & Starkstein, S. (2015). Cognitive Behaviour Therapy for Depression and Anxiety in Parkinson's Disease. Journal of Parkinsons Disease, 5(3), 443–451. doi:10.3233/JPD-150542
Erga, A.H., Alves, G., Larsen, J.P., Tysnes, O.B., & Pedersen, K.F. (2017). Impulsive and Compulsive Behaviors in Parkinson's Disease: The Norwegian ParkWest Study. Journal of Parkinsons Disease, 7(1), 183–191. doi:10.3233/JPD-160977
Erga, A.H., Dalen, I., Ushakova, A., Chung, J., Tzoulis, C., Tysnes, O. B., … Maple-Grødem, J. (2018). Dopaminergic and Opioid Pathways Associated with Impulse Control Disorders in Parkinson’s Disease. Frontiers in Neurology, 9. doi:10.3389/fneur.2018.00109
Evans, D., & Norman, P. (2009). Illness representations, coping and psychological adjustment to Parkinson's disease. Psychology & Health, 24(10), 1181–1196. doi:10.1080/08870440802398188
Gjerstad, M.D., Alves, G., Wentzel-Larsen, T., Årsland, D., & Larsen, J.P. (2015). Excessive daytime sleepiness in Parkinson disease: is it the drugs or the disease?. Neurology, 85(2), 162–168.
Gjerstad, M. D., Wentzel-Larsen, T., Årsland, D., & Larsen, J. P. (2007). Insomnia in Parkinson's disease: frequency and progression over time. Journal of Neurology, Neurosurgery and Psychiatry, 78(5), 476–479. doi:10.1136/jnnp.2006.100370
Hurt, C.S., Thomas, B.A., Burn, D.J., Hindle, J.V., Landau, S., Samuel, M., … Brown, R.G. (2011). Coping in Parkinson's disease: an examination of the coping inventory for stressful situations. International Journal of Geriatric Psychiatry, 26(10), 1030–1037. doi:10.1002/gps.2634
Julien, C.L., Rimes, K.A., & Brown, R.G. (2016). Rumination and behavioural factors in Parkinson's disease depression. Journal of Psychosomatic Research, 82, 48–53. doi:10.1016/j.jpsychores.2016.01.008
Kluger, B.M., Pedersen, K.F., Tysnes, O.B., Ongre, S.O., Oygarden, B., & Herlofson, K. (2017). Is fatigue associated with cognitive dysfunction in early Parkinson's disease? Parkinsonism and Related Disorders, 37, 87–91. doi:10.1016/j.parkreldis.2017.02.005
Leentjens, A.F., Dujardin, K., Marsh, L., Martinez-Martin, P., Richard, I.H., Starkstein, S.E., … Goetz, C.G. (2008). Anxiety rating scales in Parkinson's disease: critique and recommendations. Movement Disorders, 23(14), 2015–2025. doi:10.1002/mds.22233
Leiknes, I., Tysnes, O.B., Årsland, D., & Larsen, J.P. (2010). Caregiver distress associated with neuropsychiatric problems in patients with early Parkinson's disease: the Norwegian ParkWest study. Acta Neurologica Scandinavica, 122(6), 418–424. doi:10.1111/j.1600-0404.2010.01332.x
Marsh, L., McDonald, W.M., Cummings, J., Ravina, B., Depression, N.N.W.G. o., & Parkinson's, D. (2006). Provisional diagnostic criteria for depression in Parkinson's disease: report of an NINDS/NIMH Work Group. Movement Disorders, 21(2), 148–158. doi:10.1002/mds.20723
Molde, H., Moussavi, Y., Kopperud, S.T., Erga, A.H., Hansen, A.L., & Pallesen, S. (2018). Impulse-Control Disorders in Parkinson's Disease: A Meta-Analysis and Review of Case-Control Studies. Frontiers in Neurology, 9, 330. doi:10.3389/fneur.2018.00330
Okai, D., Askey-Jones, S., Samuel, M., David, A.S., & Brown, R.G. (2015). Predictors of response to a cognitive behavioral intervention for impulse control behaviors in Parkinson's disease. Movement Disorders, 30(5), 736–739. doi:10.1002/mds.26108
Okai, D., Askey-Jones, S., Samuel, M., O'Sullivan, S.S., Chaudhuri, K.R., Martin, A., … David, A.S. (2013). Trial of CBT for impulse control behaviors affecting Parkinson patients and their caregivers. Neurology, 80(9), 792–799. doi:10.1212/WNL.0b013e3182840678
Patel, S., Ojo, O., Genc, G., Oravivattanakul, S., Huo, Y., Rasameesoraj, T., … Fernandez, H.H. (2017). A Computerized Cognitive behavioral therapy Randomized, Controlled, pilot trial for insomnia in Parkinson Disease (ACCORD-PD). Journal of Clinical Movement Disorders, 4, 16. doi:10.1186/s40734-017-0062-2
Pedersen, K.F., Larsen, J.P., Alves, G., & Årsland, D. (2009). Prevalence and clinical correlates of apathy in Parkinson's disease: a community-based study. Parkinsonism and Related Disorders, 15(4), 295–299. doi:10.1016/j.parkreldis.2008.07.006
Pringsheim, T., Jette, N., Frolkis, A., & Steeves, T.D. (2014). The prevalence of Parkinson's disease: a systematic review and meta-analysis. Mov Disord, 29(13), 1583–1590. doi:10.1002/mds.25945
Reijnders, J.S., Ehrt, U., Weber, W.E., Årsland, D., & Leentjens, A.F. (2008). A systematic review of prevalence studies of depression in Parkinson's disease. Movement Disorders, 23(2), 183–189; quiz 313. doi:10.1002/mds.21803
Santangelo, G., Raimo, S., & Barone, P. (2017). The relationship between Impulse Control Disorders and cognitive dysfunctions in Parkinson's Disease: A meta-analysis. Neuroscience & Biobehavioral Reviewes, 77, 129–147. doi:10.1016/j.neubiorev.2017.02.018
Secker, D.L., & Brown, R.G. (2005). Cognitive behavioural therapy (CBT) for carers of patients with Parkinson's disease: a preliminary randomised controlled trial. Journal of Neurology Neurosurgery and Psychiatry, 76(4), 491–497. doi:10.1136/jnnp.2004.042291
Tholfsen, L.K., Larsen, J.P., Schulz, J., Tysnes, O.B., & Gjerstad, M.D. (2015). Development of excessive daytime sleepiness in early Parkinson disease. Neurology, 85(2), 162–168. doi:10.1212/WNL.0000000000001737
Videnovic, A. (2017). Management of sleep disorders in Parkinson's disease and multiple system atrophy. Movement Disorders, 32(5), 659–668. doi:10.1002/mds.26918
Voon, V., Napier, T.C., Frank, M.J., Sgambato-Faure, V., Grace, A.A., Rodriguez-Oroz, M., … Fernagut, P.O. (2017). Impulse control disorders and levodopa-induced dyskinesias in Parkinson's disease: an update. Lancet Neurology, 16(3), 238–250. doi:10.1016/S1474-4422(17)30004-2
Voon, V., Sohr, M., Lang, A.E., Potenza, M.N., Siderowf, A.D., Whetteckey, J., … Stacy, M. (2011). Impulse control disorders in Parkinson disease: a multicenter case—control study. Annals in Neurology, 69(6), 986–996. doi:10.1002/ana.22356
Weintraub, D., Koester, J., Potenza, M.N., Siderowf, A.D., Stacy, M., Voon, V., … Lang, A.E. (2010). Impulse control disorders in Parkinson disease: a cross-sectional study of 3090 patients. Archives of Neurology, 67(5), 589–595. doi:10.1001/archneurol.2010.65
Årsland, D., Pahlhagen, S., Ballard, C.G., Ehrt, U., & Svenningsson, P. (2011). Depression in Parkinson disease—epidemiology, mechanisms and management. Nature Review Neurology, 8(1), 35–47. doi:10.1038/nrneurol.2011.189



Kommenter denne artikkelen