Sikkerhet og effekt av 3,4-methylendioksymetamfetamin (MDMA)-assistert psykoterapi ved posttraumatisk stresslidelse (PTSD)
Ivar Goksøyr, Tor-Morten Kvam, Susanne Lund-Høie & Lowan Stewart
-
Ivar Goksøyr
Sykehuset Østfold HF, Nordre Østfold DPS
ivar@psykologvirke.no
-
Tor-Morten Kvam
Sykehuset Østfold HF, Nordre Østfold DPS
-
Susanne Lund-Høie
Sykehuset Østfold HF, Nordre Østfold DPS
-
Lowan Stewart
Sykehuset Østfold HF, Nordre Østfold DPS; CSV Regional Medical Center, Department of Emergency Medicine
Safety and efficacy of 3,4-methylenedioxymethamphetamine (MDMA)-assisted psychotherapy in the treatment of post-traumatic stress disorder (PTSD) – a systematic review
Background: A substantial proportion of patients suffering from PTSD do not respond optimally to standard treatments and many discontinue treatment. MDMA has a complex profile of action that may be well-suited as a catalyst for therapeutic processing of traumatic experiences. However, systematic reviews of the efficacy and safety of MDMA-assisted psychotherapy for PTSD are scarce.
Method: We searched the databases Medline, Embase and Psychinfo to provide a systematic review of the literature on MDMA-assisted psychotherapy in the treatment of PTSD, focusing specifically on safety and efficacy.
Results: We identified four small randomized controlled studies (N = 88), all with treatment-resistant patients with severe to extreme PTSD. Measuring CAPS-IV, the mean effect size of the treatment was large (Cohens d =1,09) and the mean remission rate at long-term follow up was high (68 %). The treatment was not associated with cognitive impairments, increased suicidality or dependency or misuse of MDMA up to 12 months after the treatment, and the dropout rate was low (8,9 %).
Conclusions: The findings suggest that MDMA-assisted psychotherapy in the treatment of PTSD may be safe and efficacious, also in severe and treatment-resistant cases. However, due to few studies with small sample sizes, firm conclusions on the efficacy and safety of this treatment cannot be drawn.
Keywords: PTSD, MDMA, MDMA-assisted psychotherapy, treatment resistance, complex PTSD
Det psykoaktive stoffet MDMA kan være egnet i kombinasjon med psykoterapi. Hva sier forskningen om sikkerheten til og effekten av MDMAassistert psykoterapi i behandlingen av PTSD?
I 1985 ble den første konferansen om MDMA-assistert psykoterapi avholdt i USA, etter flere års lovlig terapeutisk bruk (Passie, 2018). I etterkant av det amerikanske forbudet i 1985 kan så mange som 60 000 personer i Europa alene ha fått behandling med MDMA gjennom ulovlig terapivirksomhet (Passie, 2018). Forskningen på MDMA har lenge hatt et risiko- fremfor nytteperspektiv, men de senere årene har det blitt lettere å få godkjent og finansiert kliniske studier (Feduccia et al., 2018; Passie, 2018). Det foreligger nå behandlingsstudier på MDMA-assistert psykoterapi ved tilstander som alkoholisme, sosial angst ved autisme, angst og depresjon ved livstruende sykdom og posttraumatisk stresslidelse (Amoroso, 2015; Feduccia et al., 2018). Det er gjort flest studier på PTSD, dels fordi man antar at MDMA kan ha en særlig relevant virkningsprofil for bearbeiding av traumatiske opplevelser (Amoroso, 2015).
PTSD forårsakes av overveldende hendelser, og kjennetegnes av gjenopplevelser, unngåelse av indre og ytre triggere, hypervigilans, negative endringer i tanker og følelser, som går ut over sosial og yrkesmessig funksjon. Unngåelsesatferd opprettholder og forsterker lidelsen, mens nødvendig terapeutisk bearbeiding er krevende grunnet et smalt toleransevindu. Med toleransevindu sikter vi til en sone av optimal fysiologisk aktivering mellom overaktivering på den ene siden og underaktivering på den andre, der emosjoner kan oppleves og integreres (Siegel, 1999). I blant annet amerikanske, australske og engelske retningslinjer for behandling av PTDS anbefales traumefokusert psykologisk behandling for lidelsen (Bisson et al., 2015). Medikamentell behandling med blant annet antidepressiva har en viss effekt, og kan gis som tilleggsbehandling til psykoterapi (Stein et al., 2006). Slike tradisjonelle psykofarmaka kan dempe symptomer, men ikke bidra til å bearbeide og reprosessere selve traumeminnet, noe som krever at pasienten er emosjonelt involvert. Emosjonell involvering er antageligvis nødvendig for at antatt viktige terapeutiske prosesser, som for eksempel fryktekstinksjon (McNally, 2007) og minnerekonsolidering (Feduccia & Mithoefer, 2018), kan finne sted.
Flere behandlingsmetoder for PTSD har solid evidens, men responsratene varierer sterkt, og kan ligge på rundt 60 % (Loernic et al., 2015; Steenkamp et al., 2015). Remisjonsrater varierer også, men for personer med militære traumer ligger de for eksempel på 28 - 40 % (Steenkamp et al., 2015). Som i psykoterapistudier for øvrig er også frafallsratene høye (18 - 36 %), blant annet fordi behandling er krevende (Steenkamp et al., 2015; Watkins et al., 2018).
Bedre implementering av virksom behandling og nye behandlingsformer for PTSD etterspørres (Watkins et al., 2018). Det er behov for å redusere frafall fra behandling, tilpasse terapien til enkeltindividet, intensivere behandlingsforløp, utvikle behandlingsformer for kompleks traumeproblematikk samt avklare potensialet i medikament-assistert psykoterapi, altså samtidig psykofarmakologisk og psykologisk intervensjon (Watkins et al., 2018). MDMA-assistert psykoterapi har en profil som kan ha relevans for alle disse satsningsområdene (Amoroso & Workman, 2016; Barone et al., 2019; Mithoefer, 2013).
Amerikanske legemiddelmyndigheter (FDA) har gitt MDMA-assistert psykoterapi status som gjennombruddsterapi. I dette ligger en vurdering av at behandlingen kan ha betydelige fordeler sammenlignet med tilgjengelige medikamentelle behandlingsalternativer. I tillegg har FDA forpliktet seg til å gi ekstra støtte i den siste forskningsfasen før eventuell legemiddelgodkjenning. Slike såkalte fase-tre-studier er igangsatt for å avklare generaliserbarheten til de lovende preliminære resultatene (Feduccia et al., 2018).
Farmakologisk og klinisk virkning
MDMA-molekylet ligner strukturelt både på det sentralstimulerende stoffet amfetamin og det psykedeliske stoffet meskalin (Vollenweider et al., 2002). Virkningsprofilen er kompleks, der flere nevrokjemiske og endokrine mekanismer virker sammen. MDMA virker først og fremst ved å stimulere utskillelse av presynaptisk serotonin gjennom serotonintransporteren. Virkningen skyldes også, men i mindre grad, økt utskillelse av noradrenalin og dopamin, samt økte nivåer av hormoner som oksytocin, kortisol, prolaktin og vasopressin (Dumont et al., 2009; Feduccia & Mithoefer, 2018). Studier med positronemisjonstomografi (PET) og funksjonell magnetisk resonans (fMRI) viser at MDMA påvirker et nevralt nettverk bestående av amygdala og temporal- og frontalkorteks, som sammen påvirker sosial kommunikasjon og prosessering av emosjoner og minner (Vollenweider et al., 2002).
MDMA og nær beslektede substanser tilhører en egen farmakologisk gruppe kalt entaktogener (fra gresk: «fremskaffer berøring innenfra») på grunn av kliniske virkninger som økt empati og vennlighet (Vollenweider et al., 2002). En av effektene av MDMA er at pasientens toleransevindu utvides, slik at pasienten tåler mer intens eksponering uten å bli overveldet (Amoroso, 2015). På den måten kan medikamentet ha potensial som katalysator i den terapeutiske bearbeidingen av traumet fremfor kun å virke symptomdempende. Subjektive effekter i studier av friske frivillige inkluderer glede, velvære, økt selvtillit og ekstroversjon, åpenhet og nærhet til andre, økt emosjonell sensitivitet, samt mild derealisasjon (Vollenweider et al., 2002). I terapeutisk sammenheng er det interessant at MDMA antas å føre til økt selvmedfølelse (Kamilar-Britt & Bedi, 2015), bedret toleranse for negative minner (Carhart-Harris et al., 2014), samt fryktekstinksjon og rekonsolidering av traumeminner (Feduccia & Mithoefer, 2018), prosesser av relevans for behandling av PTSD. Siden MDMA kan styrke tilknytningen og nærheten til andre (Kamilar-Britt & Bedi, 2015), kan medikamentet også bidra til en bedret terapeutisk arbeidsallianse (Johansen & Krebs, 2009).
Skadevirkninger
Skadevirkning fra rekreasjonsbruk av MDMA har blitt studert, men studiene har svakheter knyttet til retrospektivt design og blandingsmisbruk, som gjør det vanskelig å skille ut en ren MDMA-effekt, i tillegg undersøkes gjerne bruk av ecstasy, som ofte inneholder andre stoffer enn MDMA (Vollenweider et al., 2002). Studier beskriver risiko for hypertermi, overdrevent vanninntak med tilhørende hyponatremi, toleranseutvikling, søvnforstyrrelser og langtidsproblemer med hukommelse og kognitiv svikt. MDMA har blitt vurdert til å ha et moderat avhengighets- og skadepotensial (Degenhardt et al., 2010; Nutt et al., 2010).
Skadepotensialet i kliniske og rekreasjonelle settinger er ulike på grunn av forskjeller i stoffets renhet samt bruks- og doseringsvariabler. I en klinisk setting ser man for eksempel ikke utvikling av hypertermi (Dumont & Verkes, 2006). I kliniske forsøk, der mer enn 850 personer har deltatt, har ingen rapportert om vedvarende bivirkninger (Doblin et al., 2014). Det mangler imidlertid systematiske oversiktsartikler av avhengighets-, misbruks- og skadepotensialet ved bruk av MDMA i behandlingen av PTSD spesielt.
MDMA-assistert psykoterapi
MDMA-assistert psykoterapi baserer seg på ideen om at farmakologiske og psykologiske effekter skal virke sammen (Mithoefer, 2013). I denne formen for psykoterapi tas MDMA et fåtall ganger som et integrert ledd av en psykoterapiprosess (Mithoefer, 2015; Passie, 2018). Psykoterapimetoden som har blitt mest brukt hittil, kalles indrestyrt, fordi man følger og støtter opp under pasientens indre prosess, som utfolder seg når de farmakologiske effektene av MDMA bidrar til økt nærhet, åpenhet og selvmedfølelse (Kamilar-Britt & Bedi, 2015; Mithoefer, 2013; Vollenweider et al., 2002). Når en slik tilstand kommer i stedet for tilstander preget av tilbaketrekning, angst, skam, skyld og selvangrep (Frankfurt & Frazier, 2016), har man observert at tendensen til å unngå angstskapende psykisk materiale erstattes med en bevegelse mot slikt materiale (Passie, 2012; 2018). Typiske utfordringer i standard PTSD-behandling, som at pasienten unngår traumeminner og blir overveldet under eksponering, kan derfor begrenses.
Det teoretiske rasjonalet bak en indrestyrt, klientsentrert terapiform er at den endrede bevissthetstilstanden utløser en intuitiv helende prosess som terapeutens ytre strukturering kan hindre (Passie, 2018). Denne prosessen har blitt kalt «the inner healing intelligence» (Mithoefer, 2013). Begrepet er nær beslektet med «den ubevisste terapeutiske alliansen» i intensiv korttids psykodynamisk terapi (ISTDP) (Hansen et al., 2013). Når angst og derav psykologisk forsvar dempes, får denne antatte selvhelende kraften guide den terapeutiske prosessen. Det er observert at dette skjer på høyst forskjelligartede og individuelle måter, selv ved lignende opprinnelsestraumer (Mithoefer, 2013; Passie, 2012). Klinisk erfaring tilsier at kjente terapeutiske prosesser oppstår spontant og reliabelt, for eksempel indre eksponering for traumeminner, symbolsk billeddannelse, kognitiv restrukturering, ny meningsdannelse, arbeid med overføringsreaksjoner, arbeid direkte gjennom kroppen og integrasjon av selvets ulike deler (Mithoefer, 2013).
Formål
Formålet med denne oversiktsartikkelen er å gi en oppdatert gjennomgang av effekt og sikkerhet av MDMA-assistert psykoterapi gitt til pasienter med PTSD i alle typer kontrollerte, randomiserte studier som benytter standardiserte utfallsmål for PTSD-symptomatologi.
Metode
Søkeordene «MDMA AND PTSD» ble brukt i databasene Embase, Medline og PsycInfo. Inklusjonskriterier var alle studier der forskerne har brukt standardiserte utfallsmål for PTSD-symptomer i dobbeltblindede randomiserte kontrollerte studier med PTSD-pasienter i hele tidsrommet frem til 21.11.2018. Vi ekskluderte studier med mindre enn 10 deltakere. 281 studier ble identifisert gjennom søket. Søkeprosedyren er gjengitt i figur 1.
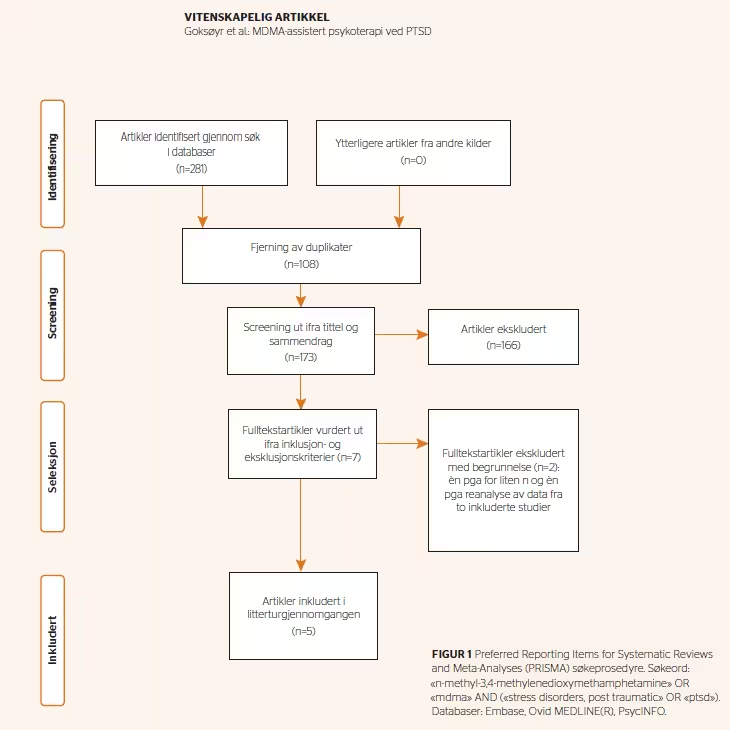
Alle studienes titler og sammendrag ble gjennomgått av samtlige forfattere hver for seg. Av disse ble 7 artikler lest i sin helhet, og det var enighet om å inkludere 5 av disse. Dataekstraksjon ble utført av to av forfatterne i samarbeid. Vi regnet ut vektet gjennomsnittlig effektstørrelse, frafallsrate og remisjonsrate.
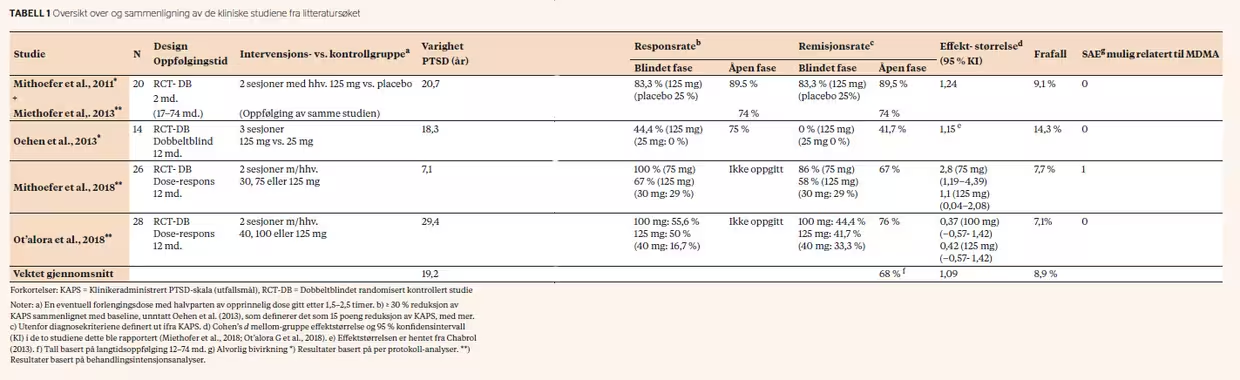
Effektdata som ble hentet ut, fremgår av tabell 1.
For å vurdere sikkerhet hentet vi ut data om bivirkninger, kognitive utfall, avhengighet, misbruk og suicidalitet.
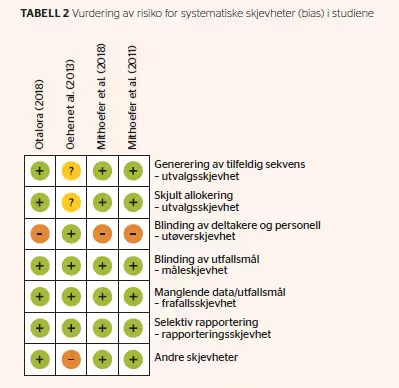
Risiko for systematiske skjevheter ble vurdert av to av forfatterne, der vi støttet oss til Cochranes sjekkliste (Higgins & Green, 2011). Denne tar utgangspunkt i seks ulike typer bias og måler intern validitet ved hjelp av konkrete kriterier for høy, lav eller uklar risiko for systematiske skjevheter. Uenigheter ble løst gjennom konsensus.
Resultater
Fem artikler fra i alt fire dobbeltblindede, randomiserte, kontrollerte studier (Mithoefer et al., 2018; Mithoefer et al., 2011; Oehen et al., 2013; Ot’alora et al., 2018) samt en oppfølgingsstudie (Mithoefer et al., 2013) fylte inklusjonskriteriene. I alle studiene sammenlignet de intervensjonen (75 - 125 mg MDMA, samt halv forlengningsdose etter 90–150 minutter) med aktiv kontroll (25 - 40 mg MDMA, samt halv forlengningsdose) eller ren placebo. Alle studiene hadde Klinikeradministrert PTSD-skala-IV (KAPS-IV) som primært utfallsmål.
Samtlige studier fulgte en versjon av terapimanualen til Mithoefer (2015), bortsett fra noen avvik i studien til Oehen og kolleger (2013). I alle studiene ble det gitt 2 - 3 åtte timer lange sesjoner med MDMA eller kontrolldose sammen med indrestyrt psykoterapi. Psykoterapi ble også gjennomført i tre forberedende samtaler samt 2 - 3 samtaler etter doseringssesjonene. Pasientene vekslet mellom introspeksjon, i utgangspunktet tilbakelent med musikk i hodetelefoner og øyemaske, og interaksjon med terapeutene, typisk en mann-kvinne-dyade.
Samtlige studier hadde en blindet kontrollert fase og en ukontrollert åpen fase med overkrysning og langtidsoppfølging, minimum 1 år. Studiene er sammenfattet i tabell 1. Det var stor variabilitet i traumene som utløste PTSD hos deltakerne i studiene. Deltakerne oppga traumer som mishandling og overgrep i barndom, traumer knyttet til militærtjeneste, utrykningsvakt, overfall og seksuelle overgrep. De viktigste eksklusjonskriteriene i studiene var borderline personlighetsforstyrrelse, psykoselidelser, misbrukslidelse de siste 60 dagene og spiseforstyrrelse med oppkast. Utvalget var preget av høy grad av komorbiditet og inkluderte stemningslidelser, angstlidelser, dissosiative lidelser, ADHD og spiseforstyrrelser. Den vanligste komorbide tilstanden var depresjon (68 - 83 %). Gjennomsnittlige utgangsskårer på KAPS lå mellom 64,9 og 92, noe som innebærer alvorlig til ekstremt PTSD-symptomtrykk.
Gjennomsnittlig tidligere behandlingslengde ble oppgitt til cirka 5 og 8 år i to studier (Mithoefer et al., 2011; Oehen et al., 2013). Oehen og medarbeidere (2013) oppga at 58 % hadde forsøkt evidensbaserte PTSD-terapier. Ot’alora og medarbeidere (2018) og Mithoefer og medarbeidere (2018) rapporterte at henholdsvis 78,3 og 35 % hadde forsøkt minst en av de evidensbaserte PTSD-terapiene EMDR, kognitiv prosesseringsterapi eller forlenget eksponeringsterapi. Henholdsvis 39,3 og 92 % hadde forsøkt kognitiv atferdsterapi (ikke nærmere definert). De aller fleste hadde i tillegg forsøkt psykofarmaka, og mange hadde prøvd andre psykoterapiformer. To studier viste at nesten halvparten hadde tidligere alvorlige selvmordstanker, og nesten en tredjedel hadde tidligere selvmordsatferd (Mithoefer et al., 2018; Ot’alora et al., 2018).
Som i andre psykoterapistudier og i studier på medisiner med markant psykoaktiv effekt hadde blindingsprosedyrene begrensninger. I Mithoefer og medarbeidere (2011), der det kun ble brukt ren placebo, gjettet alle terapeutene og 95 % av deltakerne riktig på om dosen var aktiv eller kontroll, selv om flere var usikre. I Oehen og medarbeidere (2013) gjettet totalt 59 % riktig, og i Ot’alora og medarbeidere (2018) var treffprosenten 77,3–86 % for terapeutene og 58,–72,7 % for deltakerne. Da deltakerne skulle gjette størrelsen på de ulike aktive dosene, sank treffprosenten til 59,3 og 46,3 % (Mithoefer et al., 2018).
Effekt
I studien til Mithoefer og medarbeidere (2011) sank KAPS-skårene med 53,7 poeng for MDMA-gruppen (N = 12) og 20,5 for placebogruppen (N = 8) fra en utgangsskåre på 79,4. Cohens d var 1,24 (p<0,001). Remisjonsratene var henholdsvis 83,3 % og 25 %. KAPS-skårene til to som falt fra behandlingen, ble utelatt fra analysene, men symptomene var i remisjon ved siste måling. Årsakene til frafall var reoppstart av antidepressiva og kostbar reisevei. Etter at kontrollgruppen krysset over og fikk full dose, ble den totale remisjonsraten 89,5 %. I oppfølgingsstudien gjennomsnittlig 3,5 år etter var den gjennomsnittlige nedgangen i PTSD-symptomer marginalt bedre (-55,7). 74 % var i remisjon, og da er tre deltakere som manglet KAPS-data, regnet som ikke-respondenter, selv om svar på øvrige symptomskalaer og intervju indikerte remisjon.
I studien til Oehen og kolleger (2013) ble 14 pasienter randomisert til aktiv kontroll (25 mg, N = 5) eller full dose (125 mg, N = 9), mens én falt fra i hver gruppe. Frafalte ikke medregnet, fikk intervensjonsgruppen 23 % reduksjon i KAPS-skårer mot en økning på 4,9 % i kontrollgruppen, noe som ikke var statistisk signifikant (p<0,066) grunnet lite utvalg. Effektstørrelsen ble likevel stor, d = 1,15 (Chabrol & Oehen, 2013). Selvrapporterte traumesymptomer viste statistisk signifikant symptomnedgang. I oppfølgingen ett år etter behandlingen økte både respons- og remisjonsrater markant fra behandlingslutt fra 44,4 til 75 % klinisk respons og fra 0 til 41,7 % remisjon (Oehen et al., 2013).
I studien til Mithoefer og medarbeidere (2018) sank KAPS-skårer med 58,3 (75 mg, N = 7) og 44,3 (125 mg, N =12) for intervensjonsbetingelsene og 11,4 for kontrollbetingelsen (N = 7). Resultatet var statistisk signifikant (p = 0,001) med store effektstørrelser (d = 2,8, 95 % konfidensintervall (KI) 1,19 - 4,39 for 75 mg-gruppe og d = 1,1, 95 % KI 0,04 - 2,08 for 125 mg-gruppe). Remisjonsraten var henholdsvis 86 % (75 mg), 58 % (125 mg) og 29 % (30 mg). Ved 12-måneders oppfølging hadde KAPS-skårene sunket med 54,1 (75 mg) og 51,9 (125 mg) fra utgangsskåren, og 67 % møtte ikke lenger kriteriene for PTSD.
I Ot’alora og kollegers studie (2018) (N = 28) sank KAPS-skårer med 26,3 poeng (125 mg, N = 13) og 24,4 poeng (100 mg, N = 9) for intervensjonsbetingelsene og 11,5 i kontrollgruppen (40 mg, N = 6). Statistisk signifikans ble oppnådd ved analyser av de som faktisk fullførte studien, men ikke når man inkluderte frafalte. Remisjonsraten ved endt blindet fase var henholdsvis 44,4 % (100 mg, d = 0,37, 95 %, KI -0,57 - 1,42), 41,7 % (125 mg, d = 0,42, 95 % KI -0,57 - 1,42) og 33,3 % (40 mg). I åpen fase, der alle hadde fått tre aktive doser, var reduksjonen i KAPS-skårer statistisk signifikant for alle tre gruppene sammenlignet med skårene etter to sesjoner i blindet fase. Dette viser at tre sesjoner virket bedre enn to. Gjennomsnittlig KAPS sank fra 92 til 31 ved 12 måneders oppfølging (p<0,0001). Også her var det en betydelig økt remisjonsrate etter avsluttet behandling og frem til 12 måneders oppfølging, til 76 % samlet etter overkrysning (Ot’alora et al., 2018).
Den gjennomsnittlige vektede effektstørrelsen for alle intervensjonsbetingelsene samlet var høy (Cohens d = 1,09, der 0,3 regnes som lav, 0,5 = middels og 0,8 = høy). Ved langtidsoppfølging var den gjennomsnittlige remisjonsraten på tvers av de fire studiene 68 %.
Sikkerhet
Blodtrykk, hjertefrekvens og kroppstemperatur under MDMA-øktene ble målt i alle studiene. Med unntak av Oehen og medarbeidere (2013) rapportertes midlertidig mild økning i blodtrykk, puls og kroppstemperatur i MDMA-gruppene. Økningen var statistisk signifikant, men klinisk uproblematisk.
En rekke ikke-alvorlige bivirkninger ble rapportert. De fleste gikk over av seg selv i løpet av timer eller noen få dager. Mithoefer og medarbeidere (2011) rapporterte om kjevespenninger, kvalme, kuldefornemmelse, nedsatt matlyst, svimmelhet og nedsatt balanseevne. Irritabilitet, engstelse og tap av matlyst ble noe oftere rapportert i MDMA-gruppen, mens søvnvansker og nedsatt humør ble hyppigere rapportert i placebogruppen. Oehen og medarbeidere (2013) rapporterte om tap av matlyst, økt rastløshet, hodepine, søvnløshet, kjevespenninger, tørste- og kuldefornemmelse, svimmelhet og svekket balanseevne. Ot’alora og medarbeidere (2018) rapporterte om forbigående økning i angst og kjevespenninger, hodepine, muskelspenninger, svimmelhet, tretthet og nedsatt stemningsleie under økten. Mithoefer og medarbeidere (2018) rapporterte om lignende forbigående bivirkninger.
Alvorlige bivirkninger ble rapportert i to av studiene, tre tilfeller i Ot’alora og medarbeidere (2018) og fire i Mithoefer og kolleger (2018), men kun én av disse ble vurdert mulig relatert til MDMA. En deltaker med fra før av kjente ekstra hjerteslag (ventrikulære ekstrasystoler) opplevde en midlertidig økning i slike ekstra hjerteslag, fikk overnattingsobservasjon på sykehus, men ingen komplikasjoner eller varige mén.
Suicidalitet ble målt med Columbia Suicide Severity Rating Scale (C-SSRS) i Ot’alora og medarbeidere (2018) og Mithoefer og medarbeidere (2018). Det ble ikke observert økt selvmordsatferd i noen av studiene. Nevrokognitive målinger ble gjort i alle studiene unntatt Oehen og medarbeider (2013). Det ble ikke funnet negative utfall. Ingen medisinsk behandling var ellers nødvendig under noen av behandlingsøktene.
Det ble kontrollert for eventuell bruk av MDMA utenom studieprotokollen med selvrapportering i alle studiene i tillegg til urinprøver i en av studiene (Oehen et al., 2013), uten indikasjoner for økt bruk eller avhengighet 12 måneder etter behandling.
Frafallsratene var mellom 7,1 og 14,3 %, gjennomsnittlig 8,9 %.
Risiko for systematiske skjevheter
Cochranes verktøy ble brukt for å vurdere risiko for systematiske skjevheter («bias»). For en oppsummering av resultatet av denne vurderingen, se tabell 2.
Diskusjon
MDMA-assistert psykoterapi viste langvarig reduksjon av PTSD-symptomer i de fire publiserte RCT-ene (n = 88) i denne litteraturgjennomgangen. Den høye gjennomsnittlige effektstørrelsen (d = 1,09) er sammenlignbar med tidligere funn (d = 0,9) i et dels overlappende utvalg av studier (Feduccia et al., 2018). Behandlingen var ikke assosiert med økt suicidalitet, svekkelse av kognitive funksjoner, avhengighet eller misbruk av MDMA 12 måneder etter behandlingen. Det ble rapportert en rekke bivirkninger, men få alvorlige. Høy behandlingseffekt kombinert med lave frafallsrater gjør at MDMA-assistert psykoterapi kanskje kan være lovende sammenlignet med andre behandlingsalternativer for PTSD, noe som samsvarer med indikasjoner fra en mindre metaanalyse (Amoroso & Workman, 2016).
Resultatene er særlig interessante med tanke på graden av kronifisering, alvorlighet, behandlingsresistens, komorbiditet og den betydelige andelen veteraner i utvalget, alle faktorer som kan begrense utbyttet av terapi (Steenkamp et al., 2015). Langtidsoppfølging (12 - 74 md.) viser i tillegg at effektene var opprettholdt eller forsterket, med en høy remisjonsrate (68 %) hos personer med langvarig (gjennomsnittlig 19,2 år) behandlingsresistent PTSD. Utvalget samt behandlingseffektenes størrelse og varighet gjør det usannsynlig at dette er uttrykk for placeboeffekt eller spontanremisjon, og gir derfor en mulig indikasjon på at resultatene kan skyldes behandlingen som ble gitt, tross mangel på kontrollgruppe her. Bedre kontrollerte langtidsoppfølgingsstudier med større utvalg må imidlertid til for å trekke konklusjoner om langtidseffekten av behandlingen.
Som i andre medikamentstudier ble det rapportert en rekke bivirkninger, men i studiene i denne gjennomgangen var bivirkningene kortvarige og veltolererte. Det minimale doseringsregimet der medikamentet gis kun 2 - 3 ganger utelukkende i den kliniske settingen, synes å eliminere risikoen for langvarige bivirkninger og risikoen som kjennetegner daglig selvadministrering av tradisjonelle psykofarmaka. Sammenligning av bivirkningsbildet med andre psykoterapier er vanskelig fordi bivirkninger sjelden blir rapportert i psykoterapistudier (Watkins et al., 2018). Det er også risiko knyttet til å la behandlingsresistent PTSD gå ubehandlet. Relativ risiko sammenholdt med effektdata synes foreløpig å gi MDMA-assistert psykoterapi en fordelaktig risk-nytte-profil.
Styrker og begrensninger
Styrker ved studiene i denne gjennomgangen inkluderer at de alle hadde et randomisert, kontrollert og dobbeltblindet design, der gruppene hadde nokså like utgangskarakteristika, opplæring av personell og kontroll av manualetterlevelse, validert intervjubasert utfallsmål (KAPS), langtidsoppfølging og uavhengige og blindede skårere.
Ekstern validitet styrkes av at utvalgene inkluderte personer med høy grad av behandlingsresistens, brede inklusjonskriterier med høy komorbiditetsgrad og inklusjon også av selvmordstruede pasienter. Ekstern validitet begrenses av at studiene var små og få, med manglende etnisk representativitet samt mulighet for selvseleksjon via internett til tre av studiene. Konfidensintervallene som er oppgitt, er også store, noe som betyr at tallene gir lav grad av presisjon i å estimere effekt på populasjonsnivå.
Resultatene fra to av studiene (Mithoefer et al., 2011; Oehen et al., 2013) er basert på de som fullførte behandlingen, fremfor alle de som ble randomisert til behandling. Dette er en svakhet som sammen med at Cohens d har begrensninger ved små og ulike utvalgsstørrelser på tvers av betingelser, gjør at også den samlede effektstørrelsen må tolkes med forsiktighet. Frafallet er uansett lavt, fordeler seg noenlunde likt mellom kontroll- og eksperimentgruppen og er redegjort for, noe som gjør at risiko for systematiske skjevheter fra manglende data likevel gjennomgående vurderes som lav.
Risiko for systematiske skjevheter knyttet til måling av utfall, selektiv rapportering, publisering og utvalgsskjevheter ble ved bruk av Cochranes sjekkliste vurdert som lave, med unntak av én studie (Oehen et al., 2013), der risikoen for utvalgsskjevheter var uklar. Denne studien ble også vurdert til å ha forhøyet risiko for fordreide resultater grunnet mangelfull manualetterlevelse og at kontrollgruppen hadde høyere lidelsestrykk i forkant og fikk mer psykoterapi underveis i behandlingen.
Blindingen var noe ufullstendig da antallet riktige gjetninger lå over det man ville forvente ved ren tilfeldighet (50 %). Dette innebærer en viss fare for utøverskjevheter («performance bias»), som kanskje kan ha innvirket på resultatene. Studiene er designet for å kunne bidra til legemiddelgodkjenning og har derfor prioritert sammenligning med placebo og aktiv kontroll fremfor etablerte evidensbaserte metoder for PTSD. Om ikke en svakhet ved studiene i seg selv, er dette likevel en begrensning i kunnskapsbasen.
Flere av studiene er også gjort av samme fagmiljø med bindinger til studienes sponsor, Multidisiplinary Association for Psychedelic Studies (MAPS).
Studiene har ikke design som tillater konklusjoner om virkningsmekanismer eller optimale doseringsregimer.
Resultatene på tvers av studiene er heller ikke helt konsistente.
Synergier med psykoterapi
Inkonsistenser i små utvalg kan være tilfeldig, men kan også skyldes ulikheter i hvordan psykoterapien ble gjennomført. Studien til Oehen og medarbeidere (2013) skiller seg ut med svakere resultater. De fant avvik fra den ikke-styrende terapimanualen, men studien hadde også den høyeste andelen av barndomsovergrep som opprinnelsestraume (50 %). I studien til Ot’alora og medarbeidere (2018) ble det brukt seks nyopplærte terapeutpar, og behandlingen virket saktere sammenlignet med Mithoefer og kollegers to studier, der det samme erfarne terapeutparet ble brukt. I litteraturen antas at tillit til terapeutene, forberedelser, støtte underveis og i etterkant er sentrale fasiliterende faktorer (Passie, 2018).
I evidensbaserte PTSD-behandlinger er strukturert traumebehandling et grunnleggende prinsipp, om enn mindre vektlagt ved kompleks PTSD (Amoroso & Workman, 2016; Steenkamp et al., 2015), mens man i de fire studiene i vår gjennomgang benyttet en ikke-styrende terapiform. Det trengs en empirisk avklaring av fordeler og ulemper med ulike terapiformer i kombinasjon med MDMA.
Virkning utover symptomreduksjon
I tillegg til gjennomgående høye respons- og remisjonsrater på selve traumesymptomene rapporterte flere deltakere om reduksjon av daglig psykofarmakabruk (Mithoefer et al., 2018; Ot’alora et al., 2018) og vedvarende og økende symptomlette på flere symptomskalaer samt bedret yrkesmessig, sosial og psykologisk fungering, med endret persepsjon av selv, andre og viktige livshendelser (Mithoefer et al., 2018). I en kvalitativ studie med deltakere fra Mithoefer og medarbeideres oppfølgingsstudie (2013) rapporterer flere om dypt meningsfulle terapeutiske opplevelser, økt selvrefleksjon og forbedrede relasjoner (Barone et al., 2019). I flere av studiene ser man betydelig posttraumatisk vekst (Mithoefer et al., 2018; Ot’alora et al., 2018) samt vedvarende endringer i personlighet, der især personlighetstrekkene åpenhet øker og nevrotisisme går ned (Wagner et al., 2017). Dette, sammenholdt med opprettholdte eller økte effekter etter behandling i alle studiene, indikerer at MDMA i kombinasjon med terapi, til forskjell fra tradisjonelle psykofarmakologiske intervensjoner, kan igangsette langvarige og dyptgripende terapeutiske prosesser fremfor å virke kun symptomdempende. Dette stemmer overens med klinisk erfaring og ukontrollerte studier ved terapeutisk bruk av MDMA før forbudstiden (Greer & Tolbert, 1986; Passie, 2018).
Disse funnene og forskningen på virkningsprofilen til MDMA indikerer at medikamentet kan ha et potensial som terapikatalysator for flere tilstander, som komplekse (traume-)tilstander med emosjonsregulerings-, selvbilde- og relasjonsproblematikk, og der personene har blitt utsatt for moralske krenkelser («moral injury») der skam, skyld og selvangrep dominerer (Frankfurt & Frazier, 2016). Deler av utvalgene i studiene synes å ha et slikt komplekst symptombilde. Det er uklart hvor godt tradisjonelle traumebehandlinger virker på slike tilstander, blant annet fordi de fleste PTSD-studier i liten grad aksepterer komorbiditet i utvalget (Bisson et al., 2013). Mer spekulativt kan det antas at behandlingsmetodene hviler på en smal frykt-/unngåelsesbasert traumeforståelse (Frankfurt & Frazier, 2016). Kanskje skyldes tidligere behandlingsresistens i studieutvalgene kompleksitetsgraden. Indikasjonene for om MDMA-assistert psykoterapi kan være et godt behandlingsalternativ for kompleks PTSD, er viktig å få nærmere empirisk avklart. Funnene fra studiene i denne litteraturgjennomgangen vil etterprøves i allerede igangsatte studier (clinicaltrials.gov, NCT03537014).
Konklusjon
Selv om en del av pasientene i studien rapporterte om forbigående ubehag i forbindelse med behandlingen, fant vi at MDMA-assistert psykoterapi i behandlingen av PTSD var sikkert. Den terapeutiske effekten var vedvarende, med store effektstørrelser og høye respons- og remisjonsrater i utvalg med svært varierte traumeerfaringer, høy symptombelastning, kronisitet, komorbiditet og behandlingsresistens. Når frafallsratene samtidig var lave, indikerer resultatene at MDMA-assistert psykoterapi kan være et relevant behandlingsalternativ ved PTSD. Reliabiliteten til effektestimatene er imidlertid usikre, og generaliserbarheten til funnene fra de fire studiene begrenses av små utvalg. Større studier må til for å trekke konklusjoner. Det er videre behov for å avklare om MDMA-assistert psykoterapi kan ha et terapeutiske potensial for kompleks PTSD og andre tilstander. I tillegg trengs nærmere undersøkelser av hvilke terapimetoder som eventuelt fungerer optimalt i kombinasjon med MDMA, og hvilke terapeutiske mekanismer som her gjør seg gjeldende.
–––––––––––––––––––––––––––––––––––––––––––––-
INTERESSEKONFLIKT: Alle forfatterne har tilknytning til Psykforsk – Innovativ behandlingsforskning ved Sykehuset i Østfold, som forbereder klinisk forskning på MDMA-assistert psykoterapi i samarbeid med sponsoren for alle studiene i denne litteraturgjennomgangen, Multidisiplinary Assosiation for Psychedelic Studies (MAPS).
Referanser
Amoroso, T. (2015). The psychopharmacology of±3, 4 methylenedioxymethamphetamine and its role in the treatment of posttraumatic stress disorder. Journal of Psychoactive Drugs, 47(5), 337 - 344. https://doi.org/10.1080/02791072.2015.1094156
Amoroso, T., & Workman, M. (2016). Treating posttraumatic stress disorder with MDMA-assisted psychotherapy: a preliminary meta-analysis and comparison to prolonged exposure therapy. Journal of Psychopharmacology, 30(7), 595 - 600. https://doi.org/10.1177/0269881116642542
Barone, W., Beck, J., Mitsunaga-Whitten, M., & Perl, P. (2019). Perceived benefits of MDMA-assisted psychotherapy beyond symptom reduction: qualitative follow-up study of a clinical trial for individuals with treatment-resistant PTSD. Journal of Psychoactive Drugs, 51(2), 199 - 208. https://doi.org/10.1080/02791072.2019.1580805
Bisson, J.I., Cosgrove, S., Lewis, C., & Roberts, N.P. (2015). Post-traumatic stress disorder. The British Medical Journal, 351, h6161. https://doi.org/10.1136/bmj.h6161
Bisson, J.I., Roberts, N.P., Andrew, M., Cooper, R., & Lewis, C. (2013). Psychological therapies for chronic post‐traumatic stress disorder (PTSD) in adults. Cochrane Database of Systematic Reviews. 2013(12). https://doi.org/10.1002/14651858.CD003388.pub4
Carhart-Harris, R.L., Wall, M.B., Erritzoe, D., Kaelen, M., Ferguson, B., De Meer, I., … Nutt, D.J. (2014). The effect of acutely administered MDMA on subjective and BOLD-fMRI responses to favourite and worst autobiographical memories. International Journal of Neuropsychopharmacology, 17(4), 527 - 540. https://doi.org/10.1017/S1461145713001405
Chabrol, H., & Oehen, P. (2013). MDMA assisted psychotherapy found to have a large effect for chronic post-traumatic stress disorder. Journal of Psychopharmacology, 27(9), 865 - 866. https://doi.org/10.1177/0269881113495119
Degenhardt, L., Bruno, R., & Topp, L. (2010). Is ecstasy a drug of dependence? Drug and Alcohol Dependence, 107(1), 1 - 10. https://doi.org/10.1016/j.drugalcdep.2009.09.009
Doblin, R., Greer, G., Holland, J., Jerome, L., Mithoefer, M.C., & Sessa, B. (2014). A reconsideration and response to Parrott AC (2013) «Human psychobiology of MDMA or ‘Ecstasy’: an overview of 25 years of empirical research». Human Psychopharmacology, 29(2), 105 - 108. https://doi.org/10.1002/hup.2389
Dumont, G., & Verkes, R. (2006). A review of acute effects of 3, 4-methylenedioxymethamphetamine in healthy volunteers. Journal of Psychopharmacology, 20(2), 176 - 187. https://doi.org/10.1177/0269881106063271
Dumont, G.J., Sweep, F.C., van der Steen, R., Hermsen, R., Donders, A.R., Touw, D.J., … Verkes, R.J. (2009). Increased oxytocin concentrations and prosocial feelings in humans after ecstasy (3,4-methylenedioxymethamphetamine) administration. Social Neuroscience, 4(4), 359 - 366. https://doi.org/10.1080/17470910802649470
Feduccia, A., & Mithoefer, M. (2018). MDMA-assisted psychotherapy for PTSD: are memory reconsolidation and fear extinction underlying mechanisms? Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2018(84), 221 - 228. https://doi.org/10.1016/j.pnpbp.2018.03.003
Feduccia, A.A., Holland, J., & Mithoefer, M.C. (2018). Progress and promise for the MDMA drug development program. Psychopharmacology, 235(2), 561 - 571. https://doi.org/10.1007/s00213-017-4779-2
Frankfurt, S., & Frazier, P. (2016). A review of research on moral injury in combat veterans. Military Psychology, 28(5), 318 - 330. https://doi.org/10.1037/mil0000132
Gasser, P. (1996). Die psycholytische Psychotherapie in der Schweiz von 1988 bis 1993. Schweizer Archiv für Neurologie und Psychiatrie, 147(2), 59 - 66.
Greer, G., & Tolbert, R. (1986). Subjective reports of the effects of MDMA in a clinical setting. Journal of Psychoactive Drugs, 18(4), 319 - 327. https://doi.org/10.1080/02791072.1986.10472364
Hansen, R.S., Bakkevig, J.F., Langvasbråten, B., & Solbakken, O.A. (2013). Følelser som forandrer – Intensiv dynamisk korttidsterapi. Tidsskrift for Norsk psykologforening, 50(8), 838 - 844.
Higgins, J.& Green, S. (red.) (2011). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. The Cochrane Collaboration, 2011. Tilgjengelig fra www.handbook.cochrane.org.
Johansen, P., & Krebs, T. (2009). How could MDMA (ecstasy) help anxiety disorders? A neurobiological rationale. Journal of Psychopharmacology, 23(4), 389–391. https://doi.org/10.1177/0269881109102787
Kamilar-Britt, P., & Bedi, G. (2015). The prosocial effects of 3, 4-methylenedioxymethamphetamine (MDMA): controlled studies in humans and laboratory animals. Neuroscience & Biobehavioral Reviews, 2015(57), 433 - 446. https://doi.org/10.1016/j.neubiorev.2015.08.016
Loerinc, A.G., Meuret, A.E., Twohig, M.P., Rosenfield, D., Bluett, E.J., & Craske, M.G. (2015). Response rates for CBT for anxiety disorders: Need for standardized criteria. Clinical psychology review, 42, 72 - 82. https://doi.org/10.1016/j.cpr.2015.08.004
McNally, R.J. (2007). Mechanisms of exposure therapy: how neuroscience can improve psychological treatments for anxiety disorders. Clinical Psychology Review, 27(6), 750 - 759. https://doi.org/10.1016/j.cpr.2007.01.003
Mithoefer, M. (2013). MDMA-assisted psychotherapy: How different is it from other psychotherapy? I Doblin, R. & Burge, B. (red). Manifesting Minds: A Review of Psychedelics in Science, Medicine, Sex, and Spirituality (s. 125 - 134). Berkeley, CA: Evolver Editions.
Mithoefer, M. (19. august, 2015). A Manual for MDMA-Assisted Psychotherapy in the Treatment of Posttraumatic Stress Disorder. MAPS. https://maps.org/research-archive/mdma/MDMA-Assisted-Psychotherapy-Treat...
*Mithoefer, M.C., Mithoefer, A.T., Feduccia, A.A., Jerome, L., Wagner, M., Wymer, J., Emerson, A. (2018). 3, 4-methylenedioxymethamphetamine (MDMA)-assisted psychotherapy for post-traumatic stress disorder in military veterans, firefighters, and police officers: a randomised, double-blind, dose-response, phase 2 clinical trial. The Lancet Psychiatry, 5(6), 486 - 497. https://doi.org/10.1016/S2215-0366(18)30135-4
*Mithoefer, M.C., Wagner, M.T., Mithoefer, A.T., Jerome, L., & Doblin, R. (2011). The safety and efficacy of±3, 4-methylenedioxymethamphetamine-assisted psychotherapy in subjects with chronic, treatment-resistant posttraumatic stress disorder: the first randomized controlled pilot study. Journal of Psychopharmacology, 25(4), 439 - 452. https://doi.org/10.1177/0269881110378371
*Mithoefer, M.C., Wagner, M.T., Mithoefer, A.T., Jerome, L., Martin, S.F., Yazar-Klosinski, B., … Doblin, R. (2013). Durability of improvement in post-traumatic stress disorder symptoms and absence of harmful effects or drug dependency after 3, 4-methylenedioxymethamphetamine-assisted psychotherapy: a prospective long-term follow-up study. Journal of Psychopharmacology, 27(1), 28 - 39. https://doi.org/10.1177/0269881112456611
Nutt, D.J., King, L.A., & Phillips, L.D. (2010). Drug harms in the UK: a multicriteria decision analysis. The Lancet, 376(9752), 1558 - 1565. https://doi.org/10.1016/S0140-6736(10)61462-6
*Oehen, P., Traber, R., Widmer, V., & Schnyder, U. (2013). A randomized, controlled pilot study of MDMA (±3, 4-methylenedioxymethamphetamine)-assisted psychotherapy for treatment of resistant, chronic post-traumatic stress disorder (PTSD). Journal of Psychopharmacology, 27(1), 40 - 52. https://doi.org/10.1177/0269881112464827
*Ot’alora G.M., Grigsby, J., Poulter, B., Van Derveer, J.W., Giron, S.G., Jerome, L., … Doblin, R. (2018). 3,4-Methylenedioxymethamphetamine-assisted psychotherapy for treatment of chronic posttraumatic stress disorder: A randomized phase 2 controlled trial. Journal of Psychopharmacology, 32(12), 1295 - 1307. https://doi.org/10.1177/0269881118806297
Passie, T. (2012). Healing with entactogens: Therapist and patient perspectives on MDMA-assisted group psychotherapy. Multidisciplinary Association for Psychedelic Studies (MAPS).
Passie, T. (2018). The early use of MDMA (‘Ecstasy’) in psychotherapy (1977–1985). Drug Science, Policy and Law, 2018(4), https://doi.org/10.1177/2050324518767442
Rosenbaum, M., & Doblin, R. (1991). Why MDMA should not have been made illegal. I J.A. Inciardi (red.), The Drug Legalization Debate (s. 135 - 146). Sage Publications, Inc.
Sessa, B. (2018). The 21st century psychedelic renaissance: Heroic steps forward on the back of an elephant. Psychopharmacology, 235(2), 551 - 560. https://doi.org/10.1007/s00213-017-4713-7
Siegel, D.J. (1999). The developing mind: Toward a neurobiology of interpersonal experience. Guilford Press.
Steenkamp, M.M., Litz, B.T., Hoge, C.W., & Marmar, C.R. (2015). Psychotherapy for military-related PTSD: A review of randomized clinical trials. Jama, 314(5), 489 - 500. https://doi.org/10.1001/jama.2015.8370
Stein, D.J., Ipser, J.C., Seedat, S., Sager, C., & Amos, T. (2006). Pharmacotherapy for post traumatic stress disorder (PTSD). Cochrane Database of Systematic Reviews. 2006(1). https://doi.org/10.1002/14651858.CD002795.pub2
Vollenweider, F.X., Liechti, M.E., Gamma, A., Greer, G., & Geyer, M. (2002). Acute psychological and neurophysiological effects of MDMA in humans. Journal of Psychoactive Drugs, 34(2), 171 - 184. https://doi.org/10.1080/02791072.2002.10399951
Wagner, M.T., Mithoefer, M.C., Mithoefer, A.T., MacAulay, R.K., Jerome, L., Yazar-Klosinski, B., & Doblin, R. (2017). Therapeutic effect of increased openness: Investigating mechanism of action in MDMA-assisted psychotherapy. Journal of Psychopharmacology, 31(8), 967 - 974. https://doi.org/10.1177/0269881117711712
Watkins, L.E., Sprang, K.R., & Rothbaum, B. (2018). Treating PTSD: A review of evidence-based psychotherapy interventions. Frontiers in Behavioral Neuroscience, 12(258). https://doi.org/10.3389/fnbeh.2018.00258
