Nevrobiologisk forståelse av traumeminner
Ane Ugland Albæk & Anne Marita Milde
-
Ane Ugland Albæk
ane@albaek.no
-
Anne Marita Milde
Institutt for biologisk og medisinsk psykologi, Universitetet i Bergen
ashild.fuglestad@bergen.kommune.no
Children and youths exposure to potentially traumatizing experiences represents one of the major public health challenges of our time, causing social, cognitive, and emotional impairments. Research in neurosciences has generated valuable knowledge regarding the effects of emotional stress on the brain. The impact of early life events changes important brain functioning and structures and the underlying mechanisms involves complex cellular and molecular processes. In this article, we explore parts of the neurobiology of emotional memory and fear conditioning and translate key findings into therapeutic understanding of developmental trauma. Interventions aimed at relearning, consolidation and reconsolidation of memory can be of valuable use for patients suffering from composed trauma experiences
Key words: developmental trauma, neuroscience, memory, learning, interventions.
Moderne nevrovitenskap har gitt verdifull innsikt i nevrobiologiske prosesser som er involvert i etablering av traumatiske minner. Bedre kunnskap om disse prosessene kan øke forståelsen for hva som virker og ikke virker i terapi.
Omsorgssvikt og alvorlige krenkelser som vold og overgrep tidlig i livet utgjør en av vår tids største folkehelseutfordringer (Krug, Mercy, Dahlberg & Zwi, 2002). Senere års forskning har vist at når barn over tid eksponeres for alvorlige stressende opplevelser uten adekvat og trygg voksenstøtte, kan det få store konsekvenser for deres senere emosjonelle, sosiale og kognitive fungering (Anda et al., 2006; Van Niel, Pachter, Wade, Felitti & Stein, 2014). Slike sammensatte tidlige belastninger er ofte omtalt som potensielle utviklingstraumer (Van der Kolk, 2014).
Barn og voksne kan oppleve at sanseinntrykk som forbindes med tidligere overgrep eller truende situasjoner, også senere i livet utløser sterke affektive reaksjoner (Courtois & Ford, 2009). Karakteristisk er et trusselorientert oppmerksomhetsfokus der kraftige fryktreaksjoner kan utløses av tilsynelatende nøytrale stimuli. Om personen selv ikke forstår eller kan formidle sammenhengen, kan en slik reaksjon i seg selv oppleves som skremmende. Økt innsikt i hvordan hjernen lagrer og aktiverer fryktminner, kan hjelpe både pasienter og behandlere til lettere å forstå reaksjonsmønstre, for dermed å fasilitere opplevelse av mestring og kontroll.
I tillegg til påtrengende tanker og minnebilder inngår fragmenterte minner i kriteriene for posttraumatisk stresslidelse (PTSD; APA, 2013). Også utviklingstraumer kjennetegnes av triggerutløste stressreaksjoner og fragmentert hukommelse. Denne type symptomer kan forstås ut ifra prinsipper om assosiativ læring eller fryktbetinging (LeDoux & Pine, 2016), og spesielt tre hjerneregioner er av spesifikk interesse for å forstå fryktbetinging: amygdala, hippocampus og prefrontal korteks (Kochli, Thompson, Fricke, Postle & Quinn, 2015; Maren, Phan & Liberzon, 2013).
Hjernen er dynamisk og påvirkelig, og vi ser at dens funksjoner, topografi og organisering endres i takt med både alder og erfaringer (Shonkoff, Boyce & McEwen, 2009). I løpet av barnets to første leveår skjer det en formidabel utvikling i de synaptiske forbindelsene. Ved toårsalderen har hjernen mer enn dobbelt så mange synaptiske forbindelser som en voksen hjerne, deretter minker de sakte som følge av beskjæring av synapser, noe som skjer gjennom programmert celledød eller apoptose. Nevrologiske mekanismer avgjør hvilke synapser som overlever eller ikke, hvor forbindelsen mellom nevroner styrkes gjennom simultan aktivering (noe som er kjent som Hebbs lov (1949): «Neurons that fire together, wire together»). Dette resulterer i erfaringsbasert assosiativ læring. Både basal- og humanforskning på synaptisk plastisitet har gitt empirisk støtte til Hebbs lov (Mayford, Siegelbaum & Kandel, 2012).
Det er særlig de underliggende mekanismene for emosjonell hukommelse og fryktbetinging som relateres til utvikling og opprettholdelse av traumeminner
Denne type kommunikasjon mellom nevroner er essensiell for bedring av skader i nervesystemet, men kan også bidra til atferdsmessig dysfunksjon og psykopatologi. Eksponering for kronisk negativt stress kan for eksempel ødelegge eksplisitt minnekapasitet, og karakteristisk for stressrelaterte psykiske lidelser er redusert evne til å bruke faktakunnskap og erfaringer. Dette understøttes av studier der abnormaliteter i hippocampus og dorsolateral prefrontal korteks er funnet hos mennesker med stressrelaterte psykiske lidelser, begge områdene som er nødvendige for eksplisitt minnefunksjon (se Pittenger og Duman, (2008) for en oversikt).
Effekten av overgrep, omsorgssvikt og/eller neglisjering på en hjerne i utvikling, og da spesielt i spedbarns- og småbarnsfasen, har de siste årene fått stor forskningsoppmerksomhet, og dette har bidratt til at biologiske forklaringsmodeller for barns emosjonelle og atferdsmessige utfordringer har fått større plass (De Bellis & Zisk, 2014). Vi har i dag vitenskapelig evidens for at tidlige negative livshendelser endrer hjernens fungering, noe som kan ha livsløpsmessige negative konsekvenser (Berens, Jensen & Nelson, 2017).
Det er særlig de underliggende mekanismene for emosjonell hukommelse og fryktbetinging som relateres til utvikling og opprettholdelse av traumeminner. I terapisammenheng kan det være nyttig for behandler å ha kunnskap om hvordan hjernen bevarer eller skiller emosjonelle og kognitive minnekomponenter fra hverandre.
Emosjonell hukommelse
Vi har etter hvert fått en gryende innsikt i de underliggende nevrobiologiske mekanismene for emosjonell hukommelse (LeDoux, 2012). Ved innkoding, gjenhenting og konsolidering av skremmende opplevelser er det evidens for at hjernen har separate, parallelle systemer for å tolke triggere (systemer som inkluderer amygdala) og kontekst (som inkluderer hippocampus og medial prefrontal korteks (mPFC).
Kontekst-tolkningssystemet er essensielt for den varige reaksjonen på fryktutløsende stimuli (Kochli et al., 2015; Desmedt, Marighetto, Richter-Levin & Calendreau, 2015). I møte med en skremmende stimulus vil en ubevisst og ukontrollert fryktrespons utløses, mens en påfølgende rasjonell vurdering av kontekst kan gjøre at vi vurderer det hele som ufarlig, noe som vil kunne undertrykke fryktresponsen. For eksempel opplever vi det som vesentlig farligere å møte en slange i skogen enn å se en slange i et bur (Maren et al., 2013). Men minner er ikke fastlåste. Tvert imot ser vi at minner som reaktiveres, kan endres i form av alt fra små modifiseringer til fullstendig overskriving av det opprinnelige minnet. Vi skal komme tilbake til hvordan traumeminnenes lagringskomponenter responderer på reaktivering, da dette er viktig for å forstå hvordan minner kan omskrives. Men først må vi se litt nærmere på fryktbetinging.
Fryktbetinging
Hjernens viktigste funksjon er å sørge for vår overlevelse og tilpasning til miljømessige utfordringer og muligheter. Når vi møter en potensiell trussel, aktiveres nervesystemets stressresponssystem. Dette innebærer en alarmtilstand som fremmer en rekke autonome og endokrine endringer i den hensikt å sikre selvopprettholdelse. Disse endringene påvirker blant annet nevrale strukturer som kontrollerer emosjoner og kognisjon. Ved moderat, lavfrekvent stressbelastning som individet klarer å håndtere, vil oppmerksomheten rettes selektivt mot relevante indre eller ytre stimuli, og prosesser knyttet til læring og hukommelse intensiveres (LeDoux, 2014). Gjennom fryktbetinging kan dermed enkeltstående ekstremopplevelser etablere varige traumatiske minner. Men vel så viktig for å forstå utviklingstraumer er det at også gjentatte opplevelser av moderat utrygghet, frykt og skam kan forårsake traumatiske minner.
Fryktbetinging er en viktig del av stressresponssystemet, der en i utgangspunktet nøytral stimulus får emosjonell verdi ved at den pares med en aversiv ubetinget stimulus (Desmedt et al., 2015). Et eksempel kan være at tidligere erfaringer med vold utført av en alkoholpåvirket person, gjør at stressresponser utløses av lukten av alkohol fra menneskers pust. Slike instinktive forsvarsresponser – som at man stivner til (frysatferd), får økt hjerterate eller skvetter – er alle autonome responser som ikke krever læring (Maren, Yap & Goosen, 2001). Fryktbetinging innebærer at disse allerede eksisterende fryktresponsene, som alle oppleves som ubehagelige, først kobles til en aversiv stimulus og etter hvert til nøytrale stimuli gjennom høyere ordens betinging (Yehuda & LeDoux, 2007). Dette er en enkel form for læring, men med eksepsjonell robusthet og rask tilegnelse. I denne raske, men robuste læringen spiller hjernestrukturer som amygdala og hippocampus en viktig rolle. En forståelse av den rollen disse strukturene spiller i minnelagring av skremmende opplevelser og fremtidige farer, gir oss en inngang til å forstå både traumer generelt og utviklingstraumer spesielt.
Frykt, minner og hjernestrukturer
Amygdala er avgjørende for innlæring og minnelagring av skremmende opplevelser. Kochli og kolleger (2015) viste at rotter som eksperimentelt ble påført lesjoner i amygdala mistet evnen til fryktbetinging til miljømessige stimuli og kontekster. Andre studier har vist at elektrofysiologiske endringer ved fryktbetinging inntreffer i amygdala før de treffer andre hjerneregioner (Maren et al., 2001).
Hippocampus er sentral for å tolke kontekstuell informasjon med sikte på å unngå potensielle farer i fremtiden (Neves, Cooke & Bliss, 2008). Kontekstuell informasjon i denne sammenhengen inkluderer indre psykisk tilstand (som følelser, sult, trøtthet, varme m.m.), ytre omgivelse og sosial og relasjonell situasjon (Davidson et al., 2010). Persepsjon av tid og rekkefølge inngår også i den kontekstuelle informasjonen, og gjør det mulig å «ramme inn» minner om hendelser og skape forestillinger om fremtiden (Maren et al., 2013). Skade i hippocampus reduserer vår evne til kontekstuell fryktbetinging, men dette gjelder først og fremst nylagring av minner og ikke langtidslagring av dem (Bayley, Gold, Hopkins & Squire, 2005). Årsaken til at skade i hippocampus hemmer vår evne til å lagre nye kontekstuelle fryktminner, er at hippocampus får redusert evne til å forme og lagre kontekstuell informasjon eller representasjon (Xu et al., 2016). Det er altså ikke evnen til å lagre assosiasjon mellom kontekst og aversiv stimulus som blir hemmet.
Både hippocampus og amygdala innehar nøkkelroller både ved etablering av traumeminner og ved eventuell ekstinksjon av disse minnene, men strukturene har ulike funksjoner. Amygdala er avgjørende for koding, lagring, og gjenhenting av direkte assosiasjoner mellom kontekst eller triggere og aversive stimuli (Mahan & Ressler, 2011). Denne fryktbetingingen er non-deklarativ, altså implisitt, og aktivering av minnet gir en rask fysiologisk stressrespons. Hippocampus lagrer deklarative (eksplisitte) fakta om hendelser og er sentral når vi skal tolke og differensiere kontekstuell informasjon. Amygdalaresponsen kan moduleres av hippocampus og mPFC ved hjelp av kontekstuell tolkning og resonnement. Men er hippocampusfunksjonen redusert, kan implisitte fryktminner lagres uten deklarativ informasjon om hendelsen. Om dette skjer, betyr det at vi ikke kan redegjøre for hva som utløste stressresponsen. I tillegg kan svekket hippocampusfunksjon føre til feiltolkning av kontekst og redusert evne til å modulere stressresponsen i etterkant. Og motsatt, dersom amygdala har redusert funksjon, vil det bety at vi ikke kan lagre nye fryktminner slik at fryktresponsen uteblir (Bechara et al., 1995), noe som kan ha betydning for vår evne til overlevelse.
For utviklingstraumer og for så vidt andre stressrelaterte lidelser er det viktig å være oppmerksom på at akutt moderat stress og alvorlig kronisk stress har svært ulik effekt på læring. I hippocampus vil akutt moderat stress øke synapsefunksjon mellom nevroner, kjent som langtidspotensiering (LTP), alvorlig kronisk stress vil derimot svekke LTP og øke den kompensatoriske prosessen langtidsinhibisjon (LTD), med påfølgende atrofi, forkortning av dendritter og redusert nevrogenese (se faktaboks). I amygdala blir dendrittene remodellert og mer komplekse som følge av sammensatte mekanismer der økt LTP er én faktor (Pittenger & Duman, 2008). Bildediagnostikk bekrefter strukturelle avvik i de deler av amygdala og hippocampus som er stressensitive hos voksne med utviklingstraumer sammenlignet med en ikke-klinisk populasjon (Tottenham & Sheridan, 2010; Corbo et al., 2014). Av andre funn er redusert volum i mPFC og nedsatt aktivitet på grunn av atrofi og færre støtteceller (Pittenger & Duman, 2008). I tillegg er det evidens for at kronisk stress hemmer synaptisk plastisitet i forbindelsen fra amygdala til mPFC (Maroun & Richter-Levin, 2003), mens det i forbindelsen fra mPFC til amygdala oppstår en motsatt vekting med økt LTP og redusert LTD (Akirov & Maroun, 2006). Dette gjør mPFC mindre egnet til å regulere ned en amygdalaaktivert stressrespons. Redusert hippocampuslæring får samme konsekvens ved at kontekstuell informasjon som er nødvendig for å differensiere mellom farlige og harmløse situasjoner, vil mangle. Amygdala hos mennesker utsatt for kronisk stress er både hypersensitiv og hyperaktiv og medfører derfor at stressresponssystemet aktiveres lettere, oftere og med større intensitet.
Relevans for forståelse av utviklingstraumer
LeDoux og Pine (2016) argumenterer for at vi må etablere et «to-system»-perspektiv for å forstå hvordan mennesker reagerer på fare. De skiller da mellom (1) atferdsresponser og fysiologiske endringer i kroppen og (2) bevisste følelsestilstander opplevd som frykt eller angst. Amygdalaaktivert stressrespons utgjør system 1, mens deklarative minner er en forutsetning for system 2. For forståelsen av utviklingstraumer er dette relevant fordi fryktbetinging av barndomsopplevelser ofte i liten eller ingen grad støttes av deklarative minner. I tillegg finnes eksekutive kontrollmekanismer som hindrer tilgang av uønskede deklarative minner til bevisstheten. Anderson og Green (2001) demonstrerte at når mennesker møter stimuli som er knyttet til et uønsket minne, og de forsøker å unngå tanker om dette minnet, så blir det vanskeligere for dem å gjenkalle det avviste minnet senere. Grad av glemsel øker også parallelt med antall ganger minnet blir unngått. Personer med utviklingstraumer har derfor ofte traumatiske minner de ikke har språklig tilgang til. De kan oppleve reaktivering av fryktminner som uforståelige kroppslige og emosjonelle reaksjoner. Kanskje enda viktigere er det at traumeminner kan aktivere stressresponssystemet selv om man ikke er oppmerksom på den utløsende stimulusen eller opplever frykt (LeDoux & Pine, 2016). Stressaktivering uten at pasienten selv er seg det bevisst, kan forklare tilstedeværelse av psykosomatiske plager. Denne kunnskapen kan også avhjelpe utviklingstraumefeltets forklaringsutfordring overfor politi, rettsvesen og den allmenne befolkning når rapporter fra traumatiserte barn har vært preget av inkoherens, fragmentering og manglende deklarative minner.
Traumeminner kan aktivere stressresponssystemet selv om man ikke er oppmerksom på den utløsende stimulusen eller opplever frykt
Sterke traumatiske minner som er lagret uten deklarative minnespor, kan ligge som latente minner som plutselig kan reaktiveres av sanseinntrykk og forårsake stressaktivering i situasjonen, et fenomen som kalles relæring av fryktminner. Slik kan overveldende og overaskende reaksjoner forekomme i situasjoner med tilstrekkelig kontekstuell informasjon til å aktivere traumeminnet. I tillegg kan lagrede fryktminner blokkere for at andre assosiasjoner kan knyttes til en betinget stimulus. For eksempel dersom fottrinn i trappen (betinget stimulus) er koblet til fryktrespons, vil dette minnet kunne blokkere for at andre erfaringer kan lagres som assosiasjoner til samme lyd. Fryktbetinging kan være så robust at nye erfaringer ikke makter å etablere en reduksjon eller endring av fryktminnet. Når en slik blokkeringseffekt opptrer i en terapeutisk sammenheng, kan det hindre at nye og trygge assosiasjoner etableres.
Hva skjer når barn og voksne med utviklingstraumer ser ut til å feiltolke sine omgivelser? Forskning viser at amygdala i stor grad er involvert i oppmerksomhet og persepsjon, og påvirker hvordan vi tolker og lagrer sensorisk informasjon. Grad av nevrologisk aktivering vil her påvirke oppmerksomhetsretning eller fokus, og typisk rettes mot stimuli av lært emosjonell betydning (Phelps & LeDoux, 2005). Dette gir oss en forståelse av hvordan uhensiktsmessige fryktbetingingsresponser utløser vansker med å fokusere på nøytral informasjon og skaper konsentrasjons- og oppmerksomhetssvikt. Barnets tilpasningsvansker kan da forstås ut ifra traumeskapte orienteringsvansker. Tar man hensyn til at slike økologiske forhold kan ha påvirket barnets utvikling, kan det bidra til rett diagnostisering og tilpasset behandling.
Noen kliniske implikasjoner
For den som er i kontakt med utviklingstraumatiserte, er det nyttig å vite mer om hvordan traumebaserte fryktresponser eventuelt kan avlæres. En persons hukommelsesprofil kan også gi nyttig informasjon, og psykoedukasjon om hukommelsesvansker knyttet til utviklingstraumer kan gi mindre skamfølelse hos pasienten.
Fryktminner gjør oss i stand til å forvente og reagere på farer rundt oss. Men når våre innlærte signaler på aversive hendelser ikke lenger predikerer disse hendelsene, vil frykten for disse signalene kunne avta. For eksempel vil voldsutsatte barn som plasseres i trygge fosterhjem over tid, kunne overkomme fryktbetingede responser. Ekstinksjon har således en viktig klinisk relevans, fordi nye minner lært under en ekstinksjonsprosess konkurrerer med minner formet gjennom tidligere fryktbetinging, noe som også kan bidra til å svekke fryktresponser over tid (Monfils, Cowansage, Klann & LeDoux, 2009). Men fryktminnet blir ikke slettet, og de nye hemmende minnene kan derfor ha en mer eller mindre kortvarig og kontekstavhengig effekt (Quirk, 2002). Utfordringen i terapi er derfor å oppnå en varig avlæring. Fryktbetinging til sansestimuli er avhengig av amygdala og ikke hippocampus, men hippocampus ser likevel ut til å være sentral i forbindelse med fryktekstinksjon. Det vil si at selv om en fryktrespons er avlært i en kontekst, vil den raskt kunne relanseres dersom betinget stimulus trigges i en annen kontekst (LaBar & Phelps, 2005). Ekstinksjon er således ikke permanent. Utviklingstraumatiserte barn, unge og voksne preges ofte av utrygghet, der fryktaktivering er vanskelig å avlære. I hjelpetiltak er det derfor nødvendig med langsiktig tenkning og mye tålmodighet.
Kognitiv terapi kan bidra til å utslokke fryktminnet, men da kun det kognitive innholdet. Selve minnet som utløser fryktresponsen forblir uendret om man ikke også fokuserer på gjenopplevelse av det affektive minnet. Et affektivt minne som blir gjenkalt blir ustabilt og påvirkelig en periode før det lagres igjen, en prosess kjent som rekonsolidering. Dyrestudier har demonstrert hvordan man kan utslokke affektive fryktminner mer permanent. Monfils og kolleger (2009) gjenkalte fryktminne hos rotter like før en ekstinksjonssesjon slik at det initialt utløsende betingede stimulus ble reevaluert av rottene, og da som mindre truende stimulus. Kindt, Soeter og Vervliet (2009) ga forsøkspersoner propanolol (ikke-selektiv betareseptorantagonist som hemmer utskillelse av noradrenalin, adrenalin og dopamin) før de gjenkalte et fryktminne. Dette medførte at det gjenkalte fryktminnet hos forsøkspersonene ble utslokket ved måling 24 timer senere. Propanolol ser ut til å være mindre effektivt når det gjelder å hindre rekonsolidering av veletablerte, sterke fryktminner, enn det preparatet er i en akuttfase. Likevel ser en mer vedvarende bruk av propanolol ut til å kunne redusere hyperaktivering hos traumatiserte pasienter (se Giustino, Fitzgerald & Maren, 2016).
Pasienter med tilgang til deklarative minner innehar nevrologiske forutsetninger for å gjeninnhente episodiske og semantiske minner, og dermed et utgangspunkt for å kunne skape et verbalt innhold i terapi. Pasienter der minneaktiveringen i større grad synes begrenset til non-deklarative minner, har ikke samme mulighet til dette. Gjenhenting av minnesavtrykk kan for dem være i form av affektive og kroppslige reaksjoner aktivert av ulike stimuli. For både pasient og terapeut kan det være avklarende på et felles grunnlag å ta stilling til i hvilken grad intervensjonen skal prioritere samtalebaserte (top-down) eller affekt-/kroppsorienterte (bottom-up) tilnærminger.
Behandlingsformer med god effekt på enkelttraumer indusert etter hjernens mest sensitive utviklingsperiode i barneårene kan ikke alltid dokumentere tilsvarende effekt på utviklingstraumer (Cohen et al., 2012). Dessuten er det ikke alltid et spørsmål om enten eller. Evidens fra klinisk forskning viser at en del pasienter med kjent enkelttraumebelastning også har komorbide utviklingstraumatiserende erfaringer (Khoury et al., 2010; Schmid, Petermann & Joerg, 2013).
Psykoedukasjon om hvordan traumeminner kan lagres i ulik form og få forskjellige uttrykk, kan hjelpe pasienter med å beskrive og forstå hvordan tidligere erfaringer påvirker deres erindringsverden, symptombilder og reaksjoner. Også deling av kunnskap om sammenheng mellom traumeopplevelse og funksjonelle vansker, blant annet med hukommelse og læring, antas å ha klinisk verdi (Phoenix, 2007). Mange mennesker med utviklingstraumer kjenner skam over å ikke kunne redegjøre for hva de har opplevd, eller sine egne reaksjoner. En forståelse av at også de «husker» livshendelser, men på et annet vis, vil da kunne bidra til mindre skamfølelse.
Håp om bedre hjelp
Moderne nevrovitenskap bidrar med verdifull innsikt i hjernens plastisitet i samspill med omgivelsene. Særlig er nevrobiologisk forskning på emosjonell hukommelse av interesse for utviklingstraumefeltet. Ved å skille mellom affektiv fysiologisk fryktrespons og selvopplevd frykt kan vi forhåpentligvis øke vår forståelse for tidlige traumeminner slik at vi kan tilby bedre hjelp til barn, unge og voksne med utviklingstraumer.
Faktaboks
Betydningen av synaptisk plastisitet for assosiativ læring og hukommelse: Langtidspotensiering (LTP) er mekanismen hvor forbindelsene mellom hjernecellene styrkes (potensieres) over tid (opptil flere måneder) under innlæring, slik at handling og respons blir hensiktsmessig ut i fra situasjon (se Bliss & Lømo, 1973). Langtidsinhibisjon (longterm depression (LTD)) er en komplementær prosess. Etablert synapsefunksjon reduseres eller svekkes som følge av en initiell kraftig synaptisk stimulering (depletion eller uttømming) eller fra en mer vedvarende svak synaptisk stimulering. Resultatet er en kortikal reorganisering. LTD finnes i ulike typer nevroner som utløser ulike nevrotransmittere, men det er L-glutamat som oftest er involvert. L-glutamat agerer på flere reseptorer som NMDARs (N-methyl-D- asparate reseptorer), AMPARs (a-amino-3-hydroxy-5-methylisoxazole-4-propionic acid reseptorer), KARs (kainate reseptorer), og mGluRs (metabotropic glutamate reseptorer). LTD motvirker en potensiell takeffekt som følge av LTP og har dermed en konstruktiv funksjon. Dersom synaptisk styrke bare øker og øker vil dette hemme innkoding av ny informasjon. LTP/LTD er ikke strukturspesifikk, men er observert i korteks, lillehjernen og amygdala; det er imidlertid evidens for høyest konsentrasjon i hippocampus (se Lüscher & Malenka, 2012).
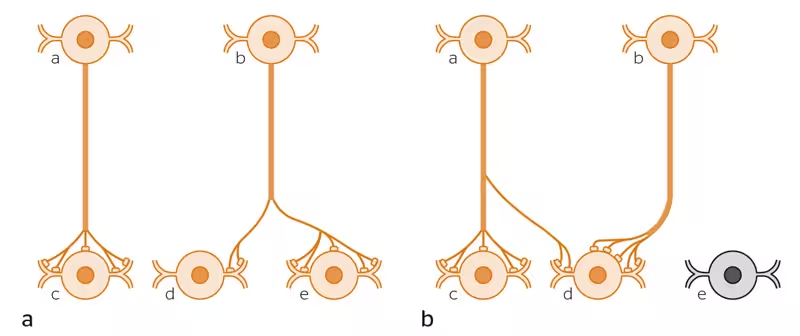
Tenkt eksempel på synaptisk plastisitet og gjenoppretting (recovery) av nerveforbindelser. a) viser koblingen mellom fem nevroner. b) viser hvordan koblingene er endret etter at celle e er blitt skadet eller ødelagt. Koblingene til den ødelagte cellen er nå trukket tilbake. Celle d har i stedet fått etablert flere synapser fra celle b. I tillegg har celle d fått synapser fra celle a, som den tidligere ikke hadde kontakt med (moderert fra Dietrichs, 2007).
Referanser
Akirav, I. & Maroun, M. (2007). The Role of the Medial Prefrontal Cortex-Amygdala Circuit in Stress Effects on the Extinction of Fear. Neural Plasticity, 30873, doi:10.1155/2007/30873
Anda, R.F., Felitti, V.J., Bremner, J., Walker, J.D., Whitfield, C.P., Bruce P.D., Giles, Wayne H. (2006). The enduring effects of abuse and related adverse experiences in childhood: A convergence of evidence from neurobiology and epidemiology. Eur Arch Psychiatry Clin Neurosci, 256(3), 174–186.
Anderson, M.C. & Green, C. (2001). Suppressing unwanted memories by executive control. Nature. Vol 410, 366–369.
American Psychiatric Association. (2013). Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (DSM-5), American Psychiatric Publishing.
Bayley, P.J., Gold, J.J., Hopkins, R.O., & Squire, L.R. (2005). The Neuroanatomy of Remote Memory. Neuron, 46(5), 799–810.
Bechara, A., Tranel, D., Damasio, H., Adolphs, R., Rockland, C., & Damasio, A.R. (1995). Double dissociation of conditioning and declarative knowledge relative to the amygdala and hippocampus in humans. Science, 25, 269 (5227), 1115–1118.
Berens, A., Jensen, S. & Nelson, C. (2017). Biological embedding of childhood adversity: From physiological mechanisms to clinical implications. BMC Medicine. 15.135
Bliss, T.V.P., & Lømo, T. (1973). Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. The Journal of Physiology, 232(2), 331–356.
Cohen, J.A., Mannarino, A.P., Kliethermes, M., & Murray, L.A. (2012). Trauma-focused CBT for youth with complex trauma. Child Abuse & Neglect, 36(6), 528–541.
Cooke, S.F., & Bliss, T.V.P. (2006). Plasticity in the human central nervous system. Brain, 129(7), 1659–1673.
Corbo, V., Salat, D.H., Amick, M.M, Leritz, E.C., Milberg, W.P., & McGlinchey R.E. (2014). Reduced cortical thickness in veterans exposed to early life trauma. Psychiatry Res. 30, 223(2), 53–60.
Courtois, C.A., & Ford, J.D. (2009). Treating Complex Traumatic Stress Disorders (Adults). Scientific Foundations and Therapeutic Models: Guilford Press.
Davidson, T.L., Kanoski, S.E., Chan, K., Clegg, D.J., Benoit, S.C., & Jarrard, L.E. (2010). Hippocampal lesions impair retention of discriminative responding based on energy state cues. Behavioral Neuroscience, 124(1), 97–105.
De Bellis, M. & Zisk, A. (2014). The Biological Effects of Childhood Trauma. Child and adolescent psychiatric clinics of North America. 23. 185–222. 10.1016/j.chc.2014.01.002.
Desmedt, A., Marighetto, A., Richter-Levin, G., & Calandreau, L. (2015). Adaptive emotional memory: the key hippocampal-amygdala interaction. Stress, 18, 297–308.
Dietrichs, E. (2007). Hjernens plastisitet – perspektiver for rehabilitering etter hjerneslag. Tidsskr Nor Legeforening No. 9, 3. 127:1228–31
Giustino T.F., Fitzgerald, P.J. & Maren S. (2016). Revisiting propranolol and PTSD: Memory erasure or extinction enhancement? Neurobiol Learn Mem. 130:26–33. doi: 10.1016/j.nlm.2016.01.009. Epub 2016 Jan 22.
Hebb, D.O. (1949). Organization of behavior. New York: Wiley,
Khoury, L., Yilamg, L.T., Bradley, B., Cubells, J.F., & Ressier, K.J. (2010) Substance abuse, childhood traumatic experiences, and posttraumatic stress disorder. Depression and Anxiety, 27(12), 1077–1088
Kindt, M. Soeter, M. & Vervliet, B. (2009). Beyond extinction: erasing human fear responses and preventing the return of fear. Nature Neuroscience 12, 256–258doi:10.1038/nn.2271
Kochli, D.E., Thompson, E.C., Fricke, E.A., Postle, A.F., & Quinn, J.J. (2015). The amygdala is critical for trace, delay, and contextual fear conditioning. Learning & Memory, 22, 1549–5485.
Krug, E.G.; Mercy, J.A.; Dahlberg, L.L. & Zwi, A.B. (2002). The World Report on Violence and Health. Lancet, 360(9339), 1083–1088, 5.
LaBar, K.S., & Phelps, E.A. (2005). Reinstatement of Conditioned Fear in Humans Is Context Dependent and Impaired in Amnesia. Behavioral Neuroscience, 119(3), 677–686.
LeDoux, J. (2012). Rethinking the Emotional Brain. Neuron, 73(4), 653–676.
LeDoux, J. (2014). Low roads and higher order thoughts in emotion. Cortex, 59(0), 214–215.
LeDoux, J. E. & Pine, D. S. (2016). Using neuroscience to help understand fear and anxiety: a two-system framework. Am. J Psychiatry 173:11, 1083–1093.
Lisman, J., Yasuda, R., & Raghavachari, S. (2012). Mechanisms of CaMKII action in long-term potentiation. Nat Rev Neurosci, 13(3), 169–182.
Lüscher, C., & Malenka, R. C. 2012. NMDA receptor-dependent long-term potentiation and long-term depression (LTP/LTD). Cold Spring Harb Perspect Biol 10.1101/cshperspect.a005710
Mahan, Amy L., & Ressler, Kerry J. (2012). Fear conditioning, synaptic plasticity and the amygdala: implications for posttraumatic stress disorder. Trends in Neurosciences, 35(1), 24–35.
Maren, S., Phan, K.L., & Liberzon, I. (2013). The contextual brain: implications for fear conditioning, extinction and psychopathology. Nat Rev Neurosci, 14(6), 417–428.
Maren, S., Yap Sa Fau, Goosens, K.A., & Goosens, K.A. (2001). The amygdala is essential for the development of neuronal plasticity in the medial geniculate nucleus during auditory fear conditioning in rats. The Journal of Neuroscience, 21(1529–2401).
Maroun M. & Richter-Levin, G. (2003). Exposure to acute stress blocks the induction of long-term potentiation of the amygdala-prefrontal cortex pathway in vivo. J Neurosci. 1;23(11):4406–9.
Mayford, M., Siegelbaum, S.A., & Kandel, E.R. (2012). Synapses and Memory Storage. Cold Spring Harbor Perspectives in Biology, 4(6), a005751. http://doi.org/10.1101/cshperspect.a005751
Monfils, M.H., Cowansage, K.K., Klann, E., & LeDoux, J.E. (2009). Extinction-reconsolidation boundaries: key to persistent attenuation of fear memories. Science. 15;324(5929):951–5. doi: 10.1126/science.1167975.
Neves, G., Cooke, S.F., & Bliss, T.V.P. (2008). Synaptic plasticity, memory and the hippocampus: a neural network approach to causality. Nat Rev Neurosci, 9(1), 65–75.
Phelps, E.A., & LeDoux, J.E. (2005). Contributions of the Amygdala to Emotion Processing: From Animal Models to Human Behavior. Neuron, 48(2), 175–187.
Phoenix, B.J. (2007). Psychoeducation for survivors of Trauma, Perspectives in Psychiatric Care, 43(3), 123–131.
Pittenger, C. & Duman, R.S. (2008). Stress, depression, and neuroplasticity: a convergence of mechanisms. Neuropsychopharmacology, 33(1), 88–109.
Quirk, G. J. (2002). Memory for Extinction of Conditioned Fear Is Long-lasting and Persists Following Spontaneous Recovery. Learning & Memory, 9(6), 402–407.
Schmid, M., Petermann, F. & Fegert, J.M. (2013). Developmental trauma disorder: pros and cons of including formal criteria in the psychiatric diagnostic systems. BMC Psychiatry201313:3 https://doi.org/10.1186/1471–244X-13–3
Shonkoff, J.P., Boyce, W., & McEwen, B.S. (2009). Neuroscience, molecular biology, and the childhood roots of health disparities: Building a new framework for health promotion and disease prevention. JAMA, 301(21), 2252–2259.
Tottenham, N. & Sheridan, M.A. (2010). A review of adversity, the amygdala and the hippocampus: a consideration of developmental timing. Frontiers in Human Neuroscience, 3.
Van Niel, C., Pachter, L.M., Wade, R. Jr., Felitti, V.J. & Stein, M.T. (2014). Adverse events in children: Predictors of adult physical and mental conditions. Journal of Developmental and Behavioral Pediatrics, 35(8), 549–551.
Van der Kolk, B. (2014). The Body Keeps the Score: Brain, Mind, and Body in the Healing of Trauma: The Penguin Group.
Xu, C., Krabbe, S., Gründemann, J., Botta, P., Fadok, J.P., Osakada, F… & Lüthi, A. (2016): Distinct Hippocampal Pathways Mediate Dissociable Roles of Context in Memory Retrieval. Cell. 167 (4). 961–972.
Yehuda, R. & LeDoux, J. (2007): Response variation following trauma: a translational neuroscience approach to understanding PTSD. Neuron. 56 (1), 19–32.
