Hvor nøyaktig identifiserer screeninginstrumentet Social Communication Questionnaire autismespekterforstyrrelser i BUP?
Beate Ørbeck, Hans Jørgen Berntsen & Kristin Romvig Øvergaard
-
Beate Ørbeck
Oslo universitetssykehus, Klinikk psykisk helse og avhengighet, Avdeling for forskning og innovasjon
b-oerbe@online.no
-
Hans Jørgen Berntsen
Akershus universitetssykehus, BUP Øvre Romerike
-
Kristin Romvig Øvergaard
Oslo universitetssykehus, Klinikk psykisk helse og avhengighet, Avdeling for forskning og innovasjon; Universitetet i Oslo, Institutt for klinisk medisin
Bakgrunn: Det er ukjent hvor godt samsvar det er mellom screeninginstrumentet Social Communication Questionnaire (SCQ) og autismespekterforstyrrelse (ASF) i BUP.
Metode: Vi undersøkte nøyaktigheten av SCQ for å korrekt klassifisere klinisk diagnostisert ASF (basert på all informasjon fra utredningen) og for ASF klassifisert av The Developmental, Dimensional and Diagnostic Interview (3Di) og The Autism Diagnostic Observation Schedule (ADOS-2).
Resultat: SCQ cutoff 15 ga lav sensitivitet (Se) for korrekt klassifisering av klinisk diagnostisert ASF (Se = 38 %), ASF klassifisert med ADOS-2 (Se = 30 %) med henholdsvis 78 og 76 % spesifisitet (Sp). For ASF klassifisert med 3Di var Se noe høyere (49 %), og det var god spesifisitet (86 %), med den beste positive prediktive verdien (.73).
Konklusjon/implikasjon: SCQ viste lav nøyaktighet i å identifisere en klinisk ASF-diagnose i BUP. Imidlertid hadde barn med SCQ-skår på eller over terskel høy risiko for også å bli kategorisert med ASF på foreldreintervjuet 3Di. Vi anbefaler at fremtidige studier inkluderer mer detaljert informasjon om hva som er grunnlaget for de endelige diagnostiske konklusjonene. Videre bør SCQ sine egenskaper vurderes i et bredt utvalg av barn med ASF som også inkluderer de med forsinket utvikling. Det er også behov for å undersøke hvor godt andre screeninginstrumenter for ASF fungerer i BUP.
Nøkkelord: Autism Diagnostic Observation Schedule (ADOS-2), sensitivitet, spesifisitet, Developmental, Dimensional and Diagnostic Interview (3Di), Social Communication Questionnaire (SCQ)
How accurate does the screening instrument Social Communication Questionnaire identify autism in child psychiatry?
Background: The accuracy of the Norwegian Social Communication Questionnaire (SCQ) in identifying autism spectrum disorder (ASD) within child psychiatry is not known.
Method: We investigated the accuracy of SCQ in identifying clinically diagnosed ASD and ASD classified by the Developmental, Dimensional and Diagnostic Interview (3Di) and the Autism Diagnostic Observation Schedule (ADOS-2).
Results: The SCQ cut-off of 15 showed low sensitivity (Se) for correct classification of clinically diagnosed ASD (Se = 38 %) and ADOS-2 classified ASD (Se = 30 %) with 78 % and 76 % specificity (SP), respectively. For 3Di classified ASD, Se was somewhat higher (49 %) and had good specificity (86 %), with the best positive predictive value (.73).
Conclusions/Implications: The SCQ showed low accuracy in identifying a clinical ASD diagnosis in child psychiatry. However, children with SCQ scores at or above threshold had a high risk of also being categorised with ASD according to the 3Di. We recommend that future studies include more detailed information about the basis for the final diagnostic conclusions. Furthermore, SCQ’s characteristics should be evaluated in samples of children within a broad range of ASD that includes individuals with delayed development. Investigation of the suitability of other screening instruments for ASD for diagnostic work in child psychiatric clinics is also needed.
Keywords: Autism Diagnostic Observation Schedule (ADOS-2), Developmental, Dimensional and Diagnostic Interview (3Di), sensitivity; specificity, Social Communication Questionnaire (SCQ)
Autismespekterforstyrrelser (ASF) karakteriseres av vedvarende vansker med sosial kommunikasjon og begrensede, repetitive adferdsmønster og interesser (Lord et al., 2018). Forekomsten er på om lag 1 %, og en metaanalyse viste en ratio for gutt : jente på nær 3 : 1 (Loomes et al., 2017). I Norge brukes det europeiske diagnosesystemet ICD-10, som har undergrupper av autisme (World Health Organization [WHO], 1990), mens det amerikanske diagnosesystemet fra 2013 benytter samlebetegnelsen ASF (American Psychiatric Association [APA], 2013). I 1990-årene og utover ble flere diagnostiske instrumenter utviklet til bruk i utredning av ASF, og den regionale norske retningslinjen anbefaler disse som standard i forskning og klinisk praksis (Regional kompetansetjeneste for autisme, ADHD, Tourettes syndrom og narkolepsi ved Helse Sør-Øst [RKT], 2019). Et sentralt diagnostisk instrument er foreldreintervjuet The Autism Diagnostic Interview-Revised (ADI-R) (Lord et al., 1994), men retningslinjen anbefaler også The Developmental, Dimensional and Diagnostic Interview (3Di) (Skuse et al., 2004).
Utover bruk av et diagnostisk intervju vektlegger retningslinjen at det gjøres en undersøkelse av barnets sosiale kommunikasjon og adferd via lek/samtale, som i The Autism Diagnostic Observation Schedule (ADOS) (Lord et al., 2012). I norsk klinisk sammenheng ansees ADOS for å være godt kjent og utprøvd (Surén, Havdahl et al., 2019). Videre presiserer retningslinjen at diagnosen ASF skal stilles ut fra en klinisk helhetsvurdering, hvor anamnese, medisinsk utredning samt kognitiv og adaptiv kartlegging inngår. Dette er viktig både differensialdiagnostisk og fordi mer enn 70 % er beskrevet å ha minst én annen samtidig lidelse (Lai et al., 2014). Blant 658 henviste amerikanske barn med ASF hadde 66 % to eller flere samtidige psykiatriske tilstander (Lecavalier et al., 2019). I tråd med internasjonale funn (Weintraub, 2011) viser studier fra Norsk pasientregister en økning av ASF hos barn uavhengig av kjønn og i alle aldersgrupper (Surén, Havdahl et al., 2019) og psykiatriske tilleggsvansker hos to tredjedeler av dem som har en ASF-diagnose registrert i 2014 (Kiselev et al., 2020).
Økt forekomst av ASF og hyppige samtidige andre tilstander gjør at utredning av barn med spørsmål om ASF utgjør en vesentlig og krevende del av arbeidet i en BUP. De differensialdiagnostiske utfordringene ble understreket i en amerikansk studie, hvor 40 % som først var gitt ASF-diagnose, ikke fylte kriteriene etter nærmere utredning (Monteiro et al., 2015). Det var derfor ønskelig at en hadde en rask måte å skille ut barn som er i behov av nærmere diagnostisk vurdering.
Følgelig har ulike screeninginstrumenter blitt utviklet, og ett slikt mål er The Social Communication Questionnaire (SCQ) (opprinnelig kalt The Autism Screening Questionnaire) (Berument et al., 1999). SCQ er et av de mest brukte screeningskjemaer for ASF i Europa (Ashwood et al., 2015), med svært gode psykometriske egenskaper i den originale studien (Berument et al., 1999). Det er imidlertid verdt å merke seg at gjennomsnittsalderen på de undersøkte i denne studien var uvanlig høy (23 år), og at SCQ ble administrert i etterkant av det diagnostiske intervjuet, ikke som en screening.
I studier av amerikanske barn fra kliniske utvalg har resultatene vært noe svakere, med en middels sensitivitet (70–80 %) hos 3–6 åringer (N = 151) (Eaves et al., 2006) og 2–16-åringer (N = 590) (Corsello et al., 2007), noe som indikerer at et flertall med ASF ble fanget opp ved screening. Begge studiene hadde også middels spesifisitet (70–80 %), som er et mål på korrekt klassifisering av barn uten ASF (altså at de som ikke har ASF, heller ikke klassifiseres med tilstanden). I to studier av barn med behov for tilrettelagt undervisning viste SCQ god sensitivitet (80–90 %) og middels spesifisitet hos 9–13 åringer (Chandler et al., 2007; Charman et al., 2007). Krysskulturell validering ble demonstrert i en tysk studie fra BUP (N = 168, gjennomsnittlig alder 14 år) med om lag 90 % sensitivitet og spesifisitet for SCQ ved anbefalt grenseverdi (15) (Bolte et al., 2008). En stor norsk populasjonsstudie fant at SCQ hadde svært lav sensitivitet (20 %) for ASF hos treåringer og identifiserte primært barn med ASF og betydelig forsinket utvikling (Surén, Saasen-Havdahl et al., 2019). Her bør en imidlertid huske på at SCQ er validert for alder ≥ 4 år (Berument et al., 1999), og en metaanalyse har konkludert med at ulike metodiske valg (som i den norske) påvirker hvor nøyaktig SCQ screener for ASF, men at instrumentet samlet sett fungerer godt (AUC (areal under kurven) = 0.88) (Chesnut et al., 2017).
Begrunnelse og forskningsspørsmål
PsykTestBarn publiserte en oppsummering av SCQ som konkluderte med at «dokumentasjonsgrunnlaget for de psykometriske egenskapene ved den norske utgaven av SCQ er noe begrenset» (Kaasbøll et al., 2021). Mange henvises likevel til BUP etter bruk av ulike screeninginstrumenter for ASF, og det er viktig å kjenne disse instrumentenes egenskaper i BUP-populasjonen. Vi vil i denne studien vurdere SCQ opp mot klinisk ASF-diagnose (basert på all informasjon fra utredningen). I tillegg har vi studert de diagnostiske grenseverdiene for ASF på de to instrumentene 3Di og ADOS-2.
Vi hadde følgende forskningsspørsmål:
Hvor nøyaktig identifiserer screeninginstrumentet SCQ en klinisk ASF-diagnose?
Hvor nøyaktig identifiserer SCQ ASF-diagnoser klassifisert med 3Di og ADOS-2?
Metode
Deltagere og prosedyre
Utvalget bestod av 92 barn og unge henvist til BUP Øvre Romerike i tidsrommet 01.06.2014–31.12.2019 og internt videre til spesialteamet for utredning av ASF. Basisutredninger inkluderte anamnese med foreldre, samtaler med foreldre, barn og lærere, skoleobservasjon, kognitiv utredning og legeundersøkelse. Gjennomsnittlig alder var 11.5 år (standardavvik (S) = 3.3 år, spredning 6–17 år), og 68.5 % var gutter. Blant dem som ble diagnostisert med ASF, var jentene to år eldre enn guttene. Gjennomsnittlig IQ var 92.1 (S = 13.4, spredning 64–121), og 74 % hadde IQ ≥ 85. ASF og tilleggsdiagnoser (hyperkinetisk forstyrrelse, adferdsforstyrrelser og angst/depresjon) ble registrert. Av de 92 som ble screenet med SCQ, ble alle også utredet med 3Di. Videre ble 75 av 92 utredet med ADOS-2.
Mål
SCQ er et mål på grad av alvorlighet for autismesymptomer hos barn ≥ 4 år med en mental alder på minst 2 år. SCQ er basert på modifiserte spørsmål fra ADI-R (Lord et al., 1994) og viste en sterk korrelasjon med dette instrumentet i den opprinnelige studien (r = .71, p < .001) (Berument et al., 1999). SCQ består av 40 spørsmål stilet til foreldre, som skal rapportere om hvorvidt adferdsmessige utviklingskjennetegn som er typiske ved ASF, er til stede (1) eller ikke (0). Den norske SCQ (2005) sammen med den engelske manualen (Rutter et al., 2003) fås hos Hogrefe forlag. SCQ kan skåres både for barn som har utviklet språk, og barn som ikke har det. Det kan også skåres ut fra nåtid eller i et livsløpsperspektiv med en grenseverdi på ≥ 15 for sannsynlig ASF. Vi benyttet skjemaet i et livsløpsperspektiv, og alle de inkluderte deltagerne hadde utviklet språk. Til forskjell fra nåtidsutgaven skal man i livsløpsutgaven skåre halvparten av spørsmålene ut fra barnets adferd i 4–5 års alder. Her presenterer vi sumskåren på SCQ, hvor spredningen i vårt utvalg var på 1–30 med gjennomsnitt 10.8 (S = 7.1).
3Di er et databasert foreldreintervju med 135 spørsmål ut fra tre dimensjoner: 1) barnets utvikling, 2) ASF-symptomer og 3) diagnostisk konklusjon i henhold til ICD-10-kriteriene for ASF (Skuse et al., 2004). Instrumentet ble oversatt til norsk i 2010. I vår undersøkelse skåret en trenet kliniker intervjusvarene fortløpende i et dataprogram. Programmet oppsummerer ASF-symptomene i en rapport som også gir ICD-10-diagnose og en sumskår. Høyere skårer på 3Di indikerer økende avvik. Vi har ikke funnet andre norske 3Di-studier utover vår egen hvor vi fant akseptabel verdi for hvor nøyaktig 3Di var til å skille mellom barn med og uten klinisk ASF-diagnose i BUP (sensitivitet/spesifisitet > 70 %) (Berntsen et al., 2021).
ADOS-2 er en revidert utgave av et standardisert, semi-strukturert intervju og en adferdsobservasjon av barn og unge for å vurdere ASF. ADOS-2 inneholder fire moduler tilpasset alder og språklig funksjonsnivå (Lord et al., 2012). Høyere skårer indikerer økende avvik, og grenseverdien for ASF-diagnose er 8. PsykTestBarn påpekte at det ennå er noe begrenset dokumentasjon på måleegenskaper for den norske utgaven av ADOS-2 (Brøndbo & Høyland, 2018). Imidlertid viste en tysk studie gjennomført i BUP god nøyaktighet av modul 3 i ADOS-2 for diagnostisering av ASF (AUC > 0.80) (Medda et al., 2019). I denne studien ble ADOS-2 modul 3 benyttet (unntatt to barn med modul 2) av erfarne klinikere med kurs i ADOS-2.
Endelige kliniske diagnoser ble fastsatt i møter med alle som deltok i utredningene basert på all innhentet informasjon fra basisutredningen og resultatene fra 3Di og ADOS-2. Her ble ICD-10-kriteriene benyttet for ASF og tilleggsdiagnoser (WHO, 1990). Vi benytter disse og samlebetegnelsen ASF for alle som fylte kriteriene for barneautisme, Asperger syndrom, atypisk autisme og uspesifisert autisme.
Statistisk bearbeiding
Statistiske analyser ble utført i SPSS (versjon 25) og ved www.medcalc.com. Forskjeller i gjennomsnitt mellom grupper ble beregnet med t-tester. Receiver operating characteristics (ROC)-analyser beregner sensitivitet og spesifisitet for de mulige grenseverdiene, og gir en grafisk fremstilling i form av en ROC-kurve. Fra ROC-kurven estimeres arealet under kurven (AUC), som gir nøyaktighet av SCQ (for alle par av sensitivitet og spesifisitet per grenseverdi). En AUC-verdi på .50 er ikke-signifikant, og betyr at målet ikke gir relevant informasjon (opp mot det valgte utfallsmål). AUC-verdiene ble vurdert slik: < 0.70 dårlig, 0.70–0.79 middels, 0.80–0.89 god og 0.90–1.00 svært god (Swets, 1988). Vi vurderte nøyaktigheten av SCQ opp mot klinisk ASF-diagnose, og mot ASF klassifisert ved 3Di og ved ADOS-2. For den anbefalte SCQ-grenseverdien (15) opp mot denne studiens tre ASF-kategorier ble det estimert sensitivitet (Se; sannsynlighet for at et mål ga korrekt klassifisering av barn med ASF) og spesifisitet (Sp; sannsynligheten for at et mål ga korrekt klassifisering av barn uten ASF). Vi beregnet positiv og negativ prediktiv verdi (PPV/NPV), som gir et mål på sannsynlighet for om et positivt/negativt testresultat tilsier at en person har / ikke har ASF. Vi beregnet også positive og negative sannsynlighetsrater: SR+ og SR–. SR+/SR– er sannsynligheten for at et barn som har / ikke har ASF, tester henholdsvis positivt/negativt, delt på sannsynligheten for at et barn som ikke har / har ASF, tester henholdsvis positivt/negativt. SR 0–1 antyder at diagnose ikke er til stede, SR = 1 antyder ingen verdi av diagnostisk test, mens SR > 1 antyder tilstedeværelse av diagnose (McGee, 2002). Vi vurderte hvilke SCQ-grenseverdier som ville gi økt Se (minst 70 %), med lavest mulig tap i Sp.
Etikk
Prosjektet er godkjent av PVO-AHUS (saksnr. 2019_59, personvernnr. 18/12414).
Resultater
I denne studien ble 37 av 92 barn (40 %) vurdert å fylle kriteriene for en klinisk ASF-diagnose. Kun 2 av 37 fikk ICD-10-diagnosen barneautisme, 22 fikk Asperger syndrom og 13 atypisk eller uspesifisert autisme. De med en klinisk ASF-diagnose hadde signifikant høyere gjennomsnittsskårer på SCQ sammenlignet med de resterende 60 % som ikke fikk ASF-diagnose (tabell 1). Det var også signifikant høyere SCQ gjennomsnittsskårer for de med ASF klassifisert ved 3Di, men ikke for de med ASF klassifisert ved ADOS-2 (tabell 1). Det var ingen signifikant forskjell i SCQ-skårer mellom de som hadde ASF med (62 %) og uten (38 %) tilleggsdiagnoser.
Tabell 1
Gjennomsnittlige SCQ-skårer for barn med og uten ASF klassifisert ved klinisk diagnostisk konklusjon, 3Di og ADOS-2

Merknad. ADOS-2: Autism Diagnostic Observation Schedule; SCQ: Social Communication Questionnaire; 3Di: The Developmental, Dimensional and Diagnostic Interview; Sa.: standardavvik; gjns.; gjennomsnitt.
Som kontinuerlig mål skilte ikke SCQ signifikant mellom sanne positive og sanne negative tilfeller av klinisk diagnostisert ASF, men det var en tendens (AUC = .61 (konfidensintervall (Ki) .49–.73, p = .07)). SCQ skilte signifikant og middels godt mellom de klassifisert med og uten ASF ved 3Di (AUC = .75 (Ki 65–85), p < .001; se figur 1), og ikke-signifikant ved ADOS-2 (AUC = .53 (Ki .39–.67), p = .67).
Figur 1
ROC-kurve som illustrerer hvor nøyaktig SCQ identifiserer ASF klassifisert ved 3Di
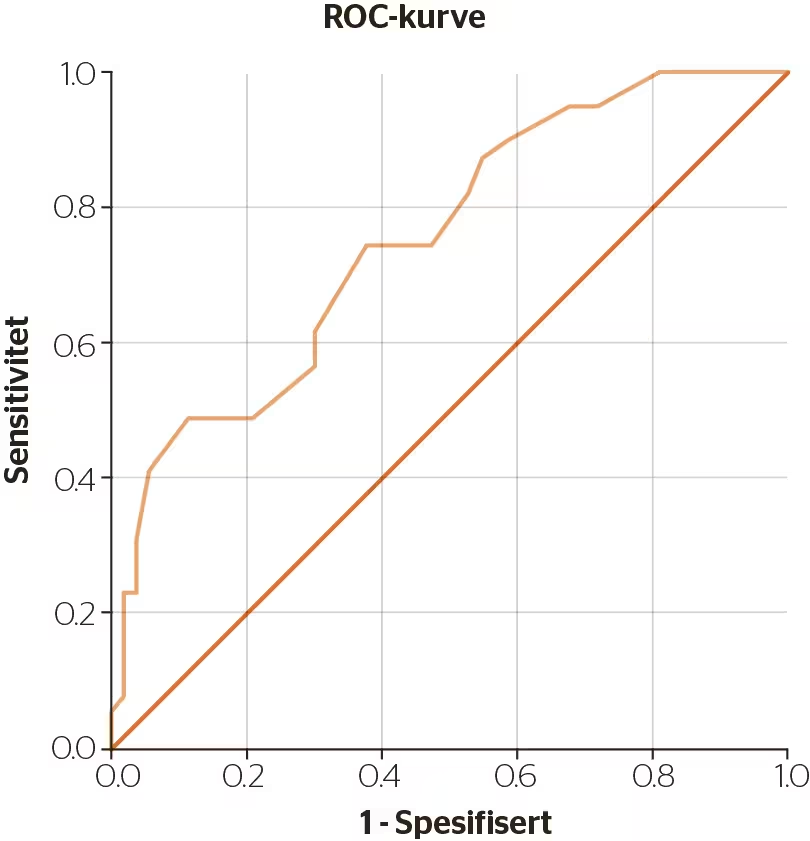
Merknad. ROC Receiver Operating Characteristics, SCQ Social Com-munication Questionnaire, 3Di The Developmental, Dimensional and Diagnostic Interview
SCQ-grenseverdi 15 ga lav sensitivitet for korrekt å identifisere klinisk diagnostisert ASF og ADOS-2-klassifisert ASF med henholdsvis Se = 38 % og 30 %, og tilhørende Sp = 78 % og 76 %. For SCQ-grenseverdi 15 opp mot 3Di-klassifisert ASF var det noe høyere sensitivitet (49 %) og spesifisitet (86 %), med den beste PPV i dette utvalget (.73).
ROC-kurvene for SCQ mot ASF klassifisert klinisk og ved ADOS-2 var ikke-signifikante, og en gunstig grenseverdi kunne ikke identifiseres. ROC-kurven for SCQ opp mot 3Di-klassifisert ASF ses i figur 1. Sammenlignet med anbefalt grenseverdi ga SCQ-grenseverdi 9 bedret sensitivitet (74 %) for 3Di, men spesifisiteten falt (53 %). Totalt sett ga senkningen i grenseverdi lite, med fall i PPV og +SR sammenlignet med den anbefalte SCQ-grenseverdien (tabell 2).
Tabell 2
SCQ-grenseverdiers diagnostiske nøyaktighet for klinisk diagnose ASF og 3Di- og ADOS-2-klassifisert ASFC

Merknad. *N = Totalt antall barn med aktuell test, n = antall med sann positiv klinisk ASF-diagnose. Andelen barn som nådde kriteriene for ASF for henholdsvis endelig klinisk diagnose, 3Di og ADOS-2 var 40 %, 42 % og 36 %.
Se Sensitivitet; Sp Spesifisitet; PPV/NPV positiv/negativ prediktiv verdi; +SR/–SR positiv/negativ sannsynlighetsrate; Ki konfidensintervall; ADOS-2 Autism diagnostic observation schedule; SCQ Social Communication Questionnaire, 3Di The Developmental, Dimensional and Diagnostic Interview
Diskusjon
I samsvar med den regionale retningslinjen ble ASF-diagnose i denne studien satt etter en samlet klinisk vurdering (RKT, 2019). Vi fant at SCQ skilte dårlig mellom sanne positive og sanne negative barn (AUC = .62), i tråd med den norske populasjonsstudien av 3-åringer (Surén, Saasen-Havdahl et al., 2019). Ved SCQ anbefalt grenseverdi (15) fant vi særlig lav sannsynlighet for å identifisere riktig de med klinisk ASF-diagnose (sensitivitet = 38 %). Dette var skuffende, da SCQ er utviklet for å bidra til å identifisere ASF hos barn. Resultatet skiller seg også fra det utviklerne fant (Berument et al., 1999) og funn fra kliniske utvalg barn og unge (Corsello et al., 2007; Eaves et al., 2006) og fra barn med tilrettelagt undervisning (Chandler et al., 2007; Charman et al., 2007), hvor variasjonen lå mellom middels til god sensitivitet og spesifisitet. Våre funn er også betydelig svakere enn resultatene fra en tysk BUP, hvor SCQ viste sensitivitet og spesifisitet på rundt 90 % (Bolte et al., 2008). Vi undersøkte om våre svakere funn kunne ha sammenheng med den norske oversettelsen, men ved en gjennomgang fant vi at denne var helt i overensstemmelse med originalen.
Av faktorer som kan påvirke nøyaktighet av screeningskjemaer, vet vi at sider ved utvalget står sentralt (Chesnut et al., 2017). Mens utvalget i den tyske studien bestod av et flertall med diagnosen barneautisme (81 %) (Bolte et al., 2008), hadde vi bare 5 % i vårt utvalg. Den svake sensitiviteten vi fant for SCQ opp mot klinisk diagnose, kan dermed ha sammenheng med at SCQ inneholder mange av de mer typiske kjennetegnene for barneautisme (som hånd-ledning, neologismer og åpenbare stereotype ytringer/bevegelser). Det var også ulik symptombyrde i det tyske utvalget og i vårt. Den tyske studien rapporterte gjennomsnittlige SCQ-skårer på 24.2 (S = 5.9) ved barneautisme og 17.5 (S = 3.5) ved de andre ASF-tilstandene, begge betydelig høyere enn sammenligningsgruppene deres (barn med adferdsvansker (8.4) og alderstypiske kontroller (5.9)). I vår studie var SCQ-gjennomsnittet for de med klinisk ASF vesentlig lavere (12.8, S = 8.1), noe som ga lavere differanse til gjennomsnittsskåren til gruppen uten klinisk ASF (9.4, S = 6.0). I tillegg hadde vi større variasjon (standard avvik) innad i gruppene enn den tyske studien. Bare 40 % av de henviste barna i vårt utvalg fikk en klinisk ASF-diagnose, som er lavere enn i en amerikansk studie, der 61 % fikk klinisk ASF-diagnose (Monteiro et al., 2015). Her utgjorde for øvrig barneautisme den største undergruppen (59 %).
I likhet med andre sammenlignbare studier fikk et flertall av de med klinisk ASF-diagnose i vårt utvalg psykiatriske tilleggsdiagnoser (62 %). Antallet var tilnærmet likt det som ble funnet i en multisenterstudie (66 %) (Lecavalier et al., 2019), og kjønnsfordelingen (68.5 % gutter) gjenspeilte en ratio på 3 : 1, som er foreslått som mest sannsynlig (Loomes et al., 2017).
Vi fant at spørreskjemaet SCQ skilte signifikant mellom barn klassifisert med og uten ASF i henhold til foreldreintervjuet 3Di, noe som ikke er overraskende av to grunner: 1) Foreldre er informanter, og 3Di er et foreldreintervju med både strukturerte og ustrukturerte spørsmål, noe som ytterligere kan tenkes å øke samsvaret mellom instrumentene. 2) SCQ ble opprinnelig utviklet basert på spørsmål fra foreldreintervjuet ADI-R. Funn fra foreldreintervjuet benyttet i vår studie (3Di) samsvarer med funn fra andre studier som viste god enighet mellom SCQ og ADI-R (Berument et al., 1999; Bishop & Norbury, 2002; Chandler et al., 2007).
Vi fant lav sensitivitet (49 %) for å fange opp 3Di-klassifisert ASF ved den anbefalte SCQ-grenseverdi (15), men god spesifisitet (86 %). SCQ ved denne grenseverdien var dermed best til å klassifisere riktig de som ikke fikk ASF ved 3Di. Likevel gir det nyttig klinisk informasjon at av de barna med SCQ ved anbefalt grenseverdi eller høyere så fikk omtrent tre av fire også klassifisert ASF ved 3Di (PPV .73).
For å øke sannsynligheten for at SCQ skulle identifisere de med ASF ved 3Di, ble det nødvendig å senke grenseverdien. Vi fant at grenseverdi 9 ga sensitivitet > 70 %, men tapte da spesifisitet ved at vi fikk flere falske positive. Bare 1 av 2 barn ble klassifisert med ASF ved 3Di (PPV .53) med denne grenseverdien. Valg av grenseverdi blir dermed en avveining mellom hva som er hensikten med screeningen, og relativ byrde knyttet til falske positive (som kan gi økt foreldrebekymring og uheldig ressursbruk) og falske negative (hvor foreldre blir sittende med alt ansvar og barnet trolig ikke får den hjelpen det trenger).
Da vi sammenlignet SCQ med ASF vurdert ved ADOS-2, skilte ikke SCQ bedre enn forventet ved gjetning (AUC = .53). Dette kan ha sammenheng med at ADOS-2 vurderes uavhengig av foreldre. Vårt funn peker i samme retning som en stor studie av barn med ASF, hvor det var høyere korrelasjon mellom SCQ og foreldreintervjuet ADI-R (.79) enn med ADOS-2 (.42) (Chandler et al., 2007).
Styrker og svakheter ved studien
Styrker ved studien er at den er utført i en vanlig klinikk ved et spesialteam i BUP. Svakheter inkluderer at vår utvalgsstørrelse ikke oversteg 100 deltagere, slik det er anbefalt for vurdering av kriterierelatert validitet (Evers et al., 2013). Videre var kun sumskåren på SCQ tilgjengelig. Vi har ikke kunnet beregne intern konsistens eller vurdere om enkeltspørsmål på SCQ var spesielt sensitive opp mot diagnose ASF. Kun 75 av 92 deltagere ble utredet med ADOS-2, men SCQ-skårene var tilnærmet lik 11 hos dem med og uten ADOS-2. Vi har en kontrastgruppe som består av barn med sosiale kommunikasjonsvansker (henvist for vurdering av ASF), noe som gjør det vanskelig å skille mellom gruppene. Den svake nøyaktigheten mellom SCQ og klinisk diagnose kan ha sammenheng med at klinikerne har vektlagt både ADOS-2, som var uten samsvar med SCQ, og funn fra annen (ikke- standardisert) informasjon når de konkluderte.
Konklusjon og kliniske implikasjoner
I vårt BUP-utvalg viste SCQ liten nøyaktighet i å identifisere en klinisk ASF-diagnose. Dette kan ha sammenheng med at SCQ inkluderer en rekke spørsmål som er særlig typisk for barneautisme, og som kun to av barna i vårt utvalg fikk diagnostisert. Likevel fant vi at SCQ viste et akseptabelt samsvar med det diagnostiske foreldreintervjuet 3Di. Klinikere bør være oppmerksomme på at de relativt få barna som får SCQ-skår tilsvarende anbefalt grenseverdi eller høyere, vil ha høy sannsynlighet for også å bli vurdert å ha ASF ved diagnostisk intervju. Ved å senke grenseverdien vil nødvendigvis screening med SCQ identifisere flere barn med ASF, men også flere uten ASF, slik det alltid vil være ved bruk av kartleggingsskjemaer. At SCQ ikke skiller ut klinisk diagnostisert ASF og ADOS-2-klassifisert ASF, kan ha sammenheng med at alle i vårt utvalg ble henvist for vurdering av vansker med sosial kommunikasjon. Slik sett kan vi anta at våre funn viser at det ofte er små forskjeller og uklare grenseoppganger mellom de som vurderes å fylle / ikke fylle diagnosekriteriene når ASF vurderes ved BUP. Vår studie tyder på at SCQ ikke er særlig nyttig for utredning av ASF i en BUP-populasjon, der de fleste har aldersgjennomsnittlig evnenivå og få diagnostiseres med barneautisme. Flere studier er imidlertid nødvendig. Fremtidige studier bør særlig vurdere SCQs egenskaper i et bredt utvalg av barn med ASF, som inkluderer barn med forsinket utvikling, og der grunnlaget for de diagnostiske konklusjonene beskrives i detalj (som funn på de diagnostiske instrumentene, skoleobservasjon eller annet).
Referanser
American Psychiatric Association (APA). (2013). Diagnostic and Statistical Manual of Mental Disorders: DSM-5. American Psychiatric Association.
Ashwood, K. L., Buitelaar, J., Murphy, D., Spooren, W. & Charman, T. (2015). European clinical network: autism spectrum disorder assessments and patient characterisation. European Child and Adolescent Psychiatry, 24(8), 985–995. https://doi.org/10.1007/s00787-014-0648-2
Berntsen, H. J., Ørbeck, B. & Romvig Øvergaard, K. (2021). Utredning av autismespekterforstyrrelser i BUP – hvor godt samsvar er det mellom instrumenter og endelig klinisk diagnose? Tidsskrift for Norsk psykologforening, 58(10). https://doi.org/10.52734/N27qU88p
Berument, S. K., Rutter, M., Lord, C., Pickles, A. & Bailey, A. (1999). Autism screening questionnaire: diagnostic validity. British Journal of Psychiatry, 175(5), 444–451. https://doi.org/10.1192/bjp.175.5.444
Bishop, D. V. & Norbury, C. F. (2002). Exploring the borderlands of autistic disorder and specific language impairment: a study using standardised diagnostic instruments. Journal of Child Psychology and Psychiatry, 43(7), 917–929. https://doi.org/10.1111/1469-7610.00114
Bolte, S., Holtmann, M. & Poustka, F. (2008). The Social Communication Questionnaire (SCQ) as a screener for autism spectrum disorders: additional evidence and cross-cultural validity. Journal of the American Academy of Child and Adolescent Psychiatry, 47(6), 719–720. https://doi.org/10.1097/CHI.0b013e31816c42bd
Brøndbo, P. H. & Høyland, A. L. (2018). Måleegenskaper ved den norske versjonen av Autism Diagnostic Observation Schedule (ADOS-2). PsykTestBarn. 1(4). https://doi.org/10.21337/0059
Chandler, S., Charman, T., Baird, G., Simonoff, E., Loucas, T., Meldrum, D., Scott, M. & Pickles, A. (2007). Validation of the social communication questionnaire in a population cohort of children with autism spectrum disorders. Journal of the American Academy of Child and Adolescent Psychiatry, 46(10), 1324–1332. https://doi.org/10.1097/chi.0b013e31812f7d8d
Charman, T., Baird, G., Simonoff, E., Loucas, T., Chandler, S., Meldrum, D. & Pickles, A. (2007). Efficacy of three screening instruments in the identification of autistic-spectrum disorders. British Journal of Psychiatry, 191, 554–559. https://doi.org/10.1192/bjp.bp.107.040196
Chesnut, S. R., Wei, T., Barnard-Brak, L. & Richman, D. M. (2017). A meta-analysis of the social communication questionnaire: Screening for autism spectrum disorder. Autism, 21(8), 920–928. https://doi.org/10.1177/1362361316660065
Corsello, C., Hus, V., Pickles, A., Risi, S., Cook, E. H., Jr., Leventhal, B. L. & Lord, C. (2007). Between a ROC and a hard place: decision making and making decisions about using the SCQ. Journal of Child Psychology and Psychiatry, 48(9), 932–940. https://doi.org/10.1111/j.1469-7610.2007.01762.x
Eaves, L. C., Wingert, H. D., Ho, H. H. & Mickelson, E. C. (2006). Screening for autism spectrum disorders with the social communication questionnaire. Journal of Developmental and Behavioral Pediatrics, 27(2 Suppl), S95–S103. https://doi.org/10.1097/00004703-200604002-00007
Evers, A., Muñiz, J., Hagemeister, C., Høtmælingen, A., Lindley, P., Sjöbergr, A. & Bartram, D. (2013). EFPA review model for the description and evaluation of psychological and educational tests. http://assessment.efpa.eu/documents-/
Kiselev, Y., Handal, M., Hjellvik, V., Reichborn-Kjennerud, T., Stoltenberg, C., Surén, P., Havdahl, A. & Skurtveit, S. (2020). Nationwide Study of Neuropsychiatric Comorbidity and Medicines Use in Children With Autism Spectrum Disorder in Norway. Frontiers in Psychiatry, 11, 596032. https://doi.org/10.3389/fpsyt.2020.596032
Kaasbøll, J., Jozefiak, T. & Aanondsen, C. M. (2021). Måleegenskaper ved den norske versjonen av Social Communication Questionnaire (SCQ). PsykTestBarn, 1(2). https://doi.org/10.21337/0071
Lai, M. C., Lombardo, M. V. & Baron-Cohen, S. (2014). Autism. Lancet, 383(9920), 896–910. https://doi.org/10.1016/S0140-6736(13)61539-1
Lecavalier, L., McCracken, C. E., Aman, M. G., McDougle, C. J., McCracken, J. T., Tierney, E., Smith, T., Johnson, C., King, B., Handen, B., Swiezy, N. B., Eugene Arnold, L., Bearss, K., Vitiello, B. & Scahill, L. (2019). An exploration of concomitant psychiatric disorders in children with autism spectrum disorder. Comprehensive Psychiatry, 88, 57–64. https://doi.org/10.1016/j.comppsych.2018.10.012
Loomes, R., Hull, L. & Mandy, W. P. L. (2017). What Is the Male-to-Female Ratio in Autism Spectrum Disorder? A Systematic Review and Meta-Analysis. Journal of the American Academy of Child and Adolescent Psychiatry, 56(6), 466–474. https://doi.org/10.1016/j.jaac.2017.03.013
Lord, C., Elsabbagh, M., Baird, G. & Veenstra-Vanderweele, J. (2018). Autism spectrum disorder. Lancet, 392(10146), 508–520. https://doi.org/10.1016/S0140-6736(18)31129-2
Lord, C., Rutter, M., Dilavore, P. C., Risi, S., Gotham, K. & Bishop, S. (2012). Autism Diagnostic Observation Schedule, Second Edition (ADOS-2) Manual (Part I): Modules 1–4. Western Psychological Services.
Lord, C., Rutter, M. & Le Couteur, A. (1994). Autism Diagnostic Interview-Revised: a revised version of a diagnostic interview for caregivers of individuals with possible pervasive developmental disorders. Journal of Autism and Developmental Disorders, 24(5), 659–685. https://doi.org/10.1007/BF02172145
McGee, S. (2002). Simplifying likelihood ratios. Journal of General Internernal Medicine, 17(8), 646–649. https://doi.org/10.1046/j.1525-1497.2002.10750.x
Medda, J. E., Cholemkery, H. & Freitag, C. M. (2019). Sensitivity and Specificity of the ADOS-2 Algorithm in a Large German Sample. Journal of Autism and Developmental Disorders, 49(2), 750–761. https://doi.org/10.1007/s10803-018-3750-3
Monteiro, S. A., Spinks-Franklin, A., Treadwell-Deering, D., Berry, L., Sellers-Vinson, S., Smith, E., Proud, M. & Voigt, R. G. (2015). Prevalence of Autism Spectrum Disorder in Children Referred for Diagnostic Autism Evaluation. Clinical Pediatrics (Phila), 54(14), 1322–1327. https://doi.org/10.1177/0009922815592607
Regional kompetansetjeneste for autisme, ADHD, Tourettes syndrom og narkolepsi ved Helse Sør-Øst [RKT]. (2019). Regional retningslinje for utredning og diagnostisering av autismespekterforstyrrelse (ASF). Oslo universitetssykehus.
Rutter, M., Bailey, A. & Lord, C. (2003). The Social Communication Questionnaire. Manual. Western Psychological Services.
Skuse, D., Warrington, R., Bishop, D., Chowdhury, U., Lau, J., Mandy, W. & Place, M. (2004). The developmental, dimensional and diagnostic interview (3di): a novel computerized assessment for autism spectrum disorders. Journal of the American Academy of Child and Adolescent Psychiatry, 43(5), 548–558. https://doi.org/10.1097/00004583-200405000-00008
Surén, P., Havdahl, A., Oyen, A. S., Schjolberg, S., Reichborn-Kjennerud, T., Magnus, P., Bakken, I. J. L. & Stoltenberg, C. (2019). Diagnostisering av autismespekterforstyrrelser hos barn i Norge. Tidsskrift for Den norske legeforening, 139(14). https://doi.org/10.4045/tidsskr.18.0960
Surén, P., Saasen-Havdahl, A., Bresnahan, M., Hirtz, D., Hornig, M., Lord, C., Reichborn-Kjennerud, T., Schjølberg, S., Øyen, A. S., Magnus, P., Susser, E., Lipkin, W. I. & Stoltenberg, C. (2019). Sensitivity and specificity of early screening for autism. BJPsych Open, 5(3), e41. https://doi.org/10.1192/bjo.2019.34
Swets, J. A. (1988). Measuring the accuracy of diagnostic systems. Science, 240(4857), 1285–1293. https://doi.org/10.1126/science.3287615
Weintraub, K. (2011). The prevalence puzzle: Autism counts. Nature, 479(7371), 22–24. https://doi.org/10.1038/479022a
World Health Organization (WHO). (1990). International Classification of Diseases and related health problems (ICD-10) (10. utg.). World Health Organization.
