Serotonin som nevromodulator i luktesystemet – generelle prinsipper i små og store hjerner
Bente G. Berg
-
Bente G. Berg
bente.berg@svt.ntnu.no
Serotonin is a prominent neuromodulator in the nervous system of various organisms. Both in humans and insects, a population of serotonergic centrifugal neurons is found to modulate incoming olfactory information in the brain. In this article, we present data from the moth brain dealing with basic features of a unique neuron of this category. By using electrophysiology and staining, combined with immunocytochemistry, we have characterized physiological properties of this centrifugal neuron, which receives input from higher brain regions and influences the sensory information at a lower level. The serotonergic arrangement in the human olfactory pathways includes a neuron population sending extensive projections from the raphe nuclei to the olfactory bulb, the counterpart to the insect antennal lobe. Thus, the arrangement of serotonergic neurons modulating olfactory information according to a top-down principle seems to be utilized across different species.
Keywords: serotonin, primary olfactory center, modulation, comparative aspects, moth olfactory pathway, two spiking amplitudes.
Serotonin er påvist som nevromodulator hos en rekke organismer. En norsk studie av nattsvermeren viser at en populasjon av serotonerge nevroner modulerer de inngående luktebaner i tråd med et «ovenfra-ned»-prinsipp.

BESLEKTET: To svepemøll-hanner (Nemophora degeerella). Arten lever i løvskog og er nokså vanlig i Sør-Norge. Kanskje bruker også disse insektene serotonin som nevromodulator. Foto: YAY Micro
Originaldata: Zhao, X.C. & Berg, B.G. (2009). Morphological and physiological characteristics of the serotonin-immunoreactive neuron in the antennal lobe of the male oriental tobacco budworm, Helicoverpa assulta. Journal of Chemical Senses, 34, 363–372.
Av alle sansesystemer er luktesansen den mest opprinnelige. Hos mennesker behandles en vesentlig del av luktinformasjonen i fylogenetisk gamle hjerneområder i temporallappen. Noen av disse, for eksempel amygdala, entorhinal korteks og hippocampus, som inngår i det limbiske system, har vist seg å være av essensiell betydning for vårt repertoar av sinnsbevegelser og vår evne til å etablere minner. At luktopplevelsen synes å være sterkt koplet både til emosjoner og hukommelse, og svakere koplet til analytisk tenkning, er derfor ikke overraskende.
Vår undersøkelse viser at ett og samme nevron kommuniserer via to ulike nerveimpulser: én som aktiveres av duftstimuli, og én som initieres i de høyere sentre og antas å virke ut fra et «ovenfra-ned»-prinsipp
Alle organismer, fra den encellede bakterie opp til mennesket, har utviklet et system for å detektere kjemiske stimuli fra sine omgivelser. Mer enn noe annet sansesystem er luktesystemet konservert gjennom evolusjonen. Bemerkelsesverdige likheter er påvist i luktebanene hos så ulike skapninger som mennesker og insekter. De universelle prinsippene omfatter blant annet strukturen på det sensoriske luktenevronet – et lite nevron som via to forgreninger danner en direkte forbindelse mellom den ytre verden og hjernen. Også menneskets luktelapp og insektets antennelobe, som med et fellesbegrep betegnes hjernens primære luktsenter, har en slående likhet i form av et nervenettverk bestående av sfæriske strukturer kalt glomeruli. Videre synes den kjemosensoriske informasjonsbehandlingen i dette hjerneområdet å være underlagt en universell logikk i form av såkalt kjemotopi. Det vil si at spesifikke duftreseptorer, og dermed spesifikke duftstimuli, representeres i distinkte glomeruli (Ressler, Sullivan & Buck, 1994; Vosshal, Wong & Axel, 2000; Zhao & Berg 2010). Denne formen for nevral organisering har fått den treffende betegnelsen «the molecular logic of smell» (Axel, 1995).
Psykiateren og nevroviteren Eric Kandel studerte en marin nakensnegl, Aplysia californica, da han utforsket basale mekanismer for plastisitet og læring. Kandel beskrev et nevralt arrangement som muliggjør modifisering av en refleks, nemlig sneglens tilbaketrekking av gjellene. I den aktuelle refleksbuen inngår en gruppe modulerende nevroner som benytter signalsubstansen serotonin (Brunelli, Castellucci & Kandel, 1976). Også andre systemer benytter serotonin som synaptisk modulator. Nattsvermeren, som er kjent for sin uvanlig velutviklede luktesans, har ett spesifikt par av serotonerge nevroner som utgjør en del av hjernens sentrale luktebaner (Dacks, Christensen & Hildebrand, 2006; Kent, Hoskins & Hildebrand, 1987). Disse vidstrakte nevronene modulerer de inngående luktsignalene i antenneloben ved å motta informasjon i ulike regioner av hjernens høyere sentre, trolig fra kanaler knyttet til andre sansemodaliteter (Kloppenburg & Mercer, 2008). På denne måten kan duftbaserte adferdsmønster til enhver tid tilpasses de spesifikke omstendigheter slik at organsimen responderer optimalt både i forhold til egen overlevelse og artens videreføring.
Med sin utsøkte luktesans og sitt relativt enkle nervesystem er den lille nattsvermeren godt egnet som modellobjekt for utforsking av luktesystemets mange hemmeligheter. Fordelen med å studere modulerende nevroner i insekthjernen er blant annet at disse nevronene kan identifiseres på bakgrunn av sin særegne morfologi, samt at det er mulig å måle nerveaktivitet i spesifikke nevroner fra en levende organisme.
Materiale og metode
Hanner av nattsvermerarten Helicoverpa assulta (Lepidoptera: Noctuidae) ble brukt i eksperimentene. Ved å benytte teknikken med intracellulære registreringer koplet til iontoforetisk farging, ble sentrale nevroner beskrevet morfologisk og fysiologisk. Videre ble det foretatt immunofarging med et antiserum mot serotonin for identifisering av aktuell signalsubstans. Dobbeltfargede preparater ble så avbildet i et konfokalmikroskop ved bruk av to ulike lasere som hver eksiterer et fluorescerende element, ett koplet til fargestoffet benyttet ved intracellulære registreringer og ett koplet til antiserumet.
Resultater og diskusjon
Som rapportert i publikasjonen av Zhao og Berg (2009), ble det gjort funn som angår basale kodingsmekanismer i det serotonerge nevronet i nattsvermerens luktebaner. Bildene fra konfokalmikroskopet viste et nevron med unik morfologi, likt det serotonerge nevronet tidligere identifisert hos andre arter (figur 1). Immunofargingen bekreftet tilstedeværelsen av serotonin. Ettersom nevronet i all hovedsak er karakterisert kun på bakgrunn av immunocytokjemi i tidligere studier, har dets fysiologi så langt vært beskjedent beskrevet. De elektrofysiologiske registreringene fra vår undersøkelse viste at nevronet kommuniserer via to ulike typer av nerveimpulser: én med liten amplitude som aktiveres av duftstimuli og som sannsynligvis initieres og opptrer kun lokalt i antenneloben, og én med en langt større amplitude som sannsynligvis initieres i de høyere sentre og opptrer globalt (figur 1c). Når det gjelder kategorien av store «spikes», antas denne å virke via et «ovenfra-ned»-prinsipp, mens den lille typen som altså reagerer på duftstimuli, antas å spille en rolle lokalt i antenneloben, muligens ved å opptre kun i avgrensede områder av de tallrike glomerulære forgreningene.
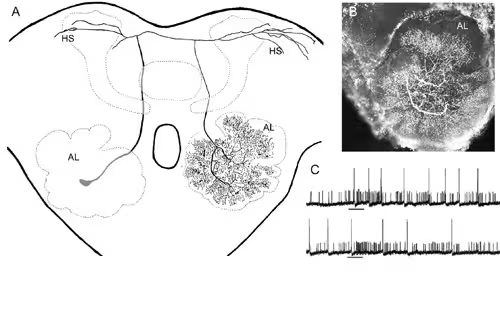
FIGUR 1: Egenskaper ved det serotonerge luktenevronet i nattsvermerhjernen. A: Komplett gjengivelse av nevronet med sin cellekropp i én antennelobe (AL) og sine tallrike projiseringer i den andre, samt sine dendritter i høyere hjernesentre (HS). B: Konfokal avbildning av nevronets tette forgreninger i AL. C: Nerveaktivitet målt i hjernens primære luktsenter. Nevronet fyrte to ulike kategorier av spike-amplituder, én liten med høy spontanaktivitet og én stor med lav spontanaktivitet. Nerveimpulsene med liten amplitude responderte på plantedufter og feromoner. Stimuleringsperioden, indikert ved en sort linje, varte i 400 ms. Fra Zhao & Berg, 2009, med tillatelse fra forlegger (Oxford University Press).
Interessant nok er aktivitet i spesifikke regioner av et nevrons distale dendritter tidligere påvist i luktelappens mitralceller (Chen, Shen, Shepherd, Hines & Midtgaard, 2002). Når det gjelder tilstedeværelsen av to typer spike-amplituder i ett og samme nevron, slik det her beskrives, kan en forestille seg at sammentreffet av to hendelser, nemlig små «spikes» som opererer lokalt i visse glomeruli av antenneloben, og store «spikes» som opererer globalt, er av betydning for dette nevronets evne til å utøve en form for distinkt modulering som er relevant nettopp for den aktuelle duftinformasjonen.
Serotonin benyttes også i modulerende nettverk i pattedyrhjernen, menneskehjernen inkludert. Serotonerge nevroner er i hovedsak påvist i mediale regioner av hjernestammen, i de såkalte rafekjernene, og har omfattende projeksjoner både til ryggmargen og forhjernen. I tillegg til basale funksjoner styrt av hypothalamus, for eksempel kardiovaskulær kontroll og termoregulering, influerer den sistnevnte banen på aktiviteten i kortikale nevroner. Det er rapportert at serotonin har betydning for mentale tilstander som humør, søvn/våkenhet, appetitt og seksualitet (Berger, Gray & Roth, 2009). Spesielt interessant i denne sammenhengen er det faktum at en subpopulasjon av de serotonerge fibrene sender tallrike projeksjoner inn i luktelappen (Matsutani & Yamamoto, 2008; McLean & Shipley, 1987). Via såkalte periglomerulære celler påvirker disse nedadgående fibrene aktiviteten i de sensoriske luktenevronene (Petzold, Hagiwara & Murthy, 2009). Videre er det vist at serotonin utøver sin rolle ved å aktivere reseptorer som influerer på nivået av kaliumstrøm, noe som korresponderer med funn fra nattsvermeren (Klein, Camardo & Kandel, 1982; Kloppenburg & Mercer, 2008). Hva angår fysiologiske egenskaper ved pattedyrs modulerende nevroner, mangler fortsatt denne kunnskapen. Imidlertid synes det å være et generelt prinsipp, hos vertebrater så vel som hos invertebrater, at serotonerge nevroner modulerer de inngående luktebanene i hjernens primære luktsenter i form av et «ovenfra-ned»-arrangement (figur 2).
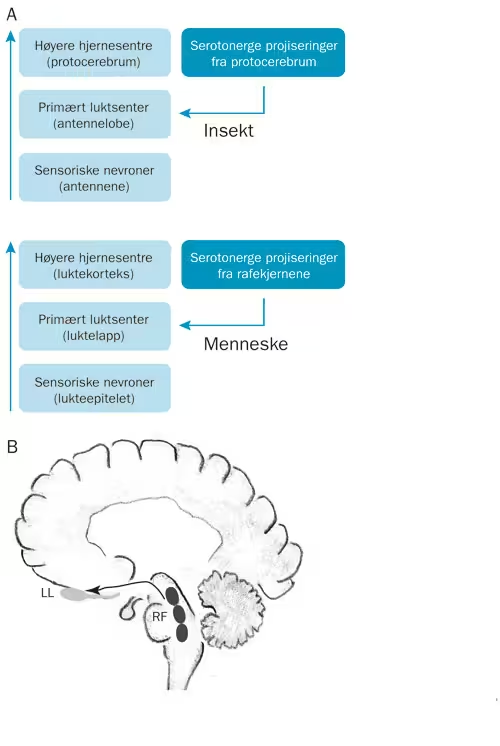
FIGUR 2: A: Sammenligning av insektets og menneskets luktesystem. Skjematisk oversikt over de inngående baner fra periferi til høyere hjernesentre, og over de serotonerge fibre som i begge systemer modulerer luktinformasjonen i det primære luktsenter. B: Skisse over menneskehjernen med sin subpopulasjon av serotonerge fibre som projiserer fra rafekjernene (RF) og inn i luktelappen (LL).
Den artsdiversitet som har utviklet seg på vår planet siden livet oppsto for ca 3,8 milliarder år siden, er i seg selv bemerkelsesverdig. Dette mangfoldet er dessuten en kilde til ny innsikt om nervesystemets sinnrike organisering både hva angår artsspesifikke eiendommeligheter og generelle prinsipper.
Konklusjon
Bruk av modelldyr, herunder invertebrater, har en lang tradisjon innenfor det interdisiplinære fagfeltet av nevrovitenskap. Arbeidet som presenteres her, omhandler basale egenskaper ved en kategori av modulerende nevron i nattsvermerhjernens luktebaner. Denne typen nevron har dendrittforgreninger i høyere hjernesentre og benytter signalsubstansen serotonin for å modulere inngående luktinformasjon i det primære luktsenteret. Nevronets fysiologiske egenskaper antyder en mekanisme for spesifikk modulering i form av at det fyrer to ulike kategorier av nerveimpulser. Interessant nok finner vi også en populasjon av serotonerge nevroner som i tråd med et «ovenfra-ned»-prinsipp, modulerer de inngående luktebaner hos pattedyr, mennesket inkludert. l
Referanser
Axel, R. (1995). The molecular logic of smell. Scientific American, 273, 154–159.
Berger, M., Gray, J. A., Roth, B. L. (2009). The expanded biology of serotonin. The annual Review of Medicine, 60, 355–366.
Brunelli, M., Castellucci, V. & Kandel, E. R. (1976). Synaptic facilitation and behavioral sensitization in Aplysia: possible role of serotonin and cyclic AMP. Science,194, 1178–1181.
Chen, W. R., Shen, G. Y., Shepherd, G. M., Hines, M. L. & Midtgaard, J. (2002). Multiple modes of action potential initiation and propagation in mitral cell primary dendrite. Journal of Neurophysiology, 88, 2755–2764.
Dacks, A. M., Christensen, T. A. & Hildebrand, J. G. (2006). Phylogeny of a serotonin-immunoreactive neuron in the primary olfactory center of the insect brain. Journal of Comparative Neurology, 498, 727–746.
Kent, K. S., Hoskins, S. G. & Hildebrand, J. G. (1987). A novel serotonin-immunoreactive neuron in the antennal lobe of the sphinx moth Manduca sexta persists throughout postembryonic life. Journal of Neurobiology, 18, 451–465.
Klein, M., Camardo, J. & Kandel, E. R. (1982). Serotonin modulates a specific potassium current in the sensory neurons that show presynaptic facilitation in Aplysia. Proceedings of the National Academy of Sciences of the United States of America, 79, 5713–5717.
Kloppenburg, P. & Mercer, A. R. (2008). Serotonin modulation of moth central olfactory neurons. Annual Review of Entomology, 53, 179–190.
Matsutani, S. & Yamamoto, N. (2008). Centrifugal innervation of the mammalian olfactory bulb. Anatomical Sciences International, 83, 218–227.
McLean, J. H. & Shipley, M. T. (1987). Serotonergic afferents to the rat olfactory bulb. II. Changes in fiber distribution during development. Journal of Neurosciences, 7, 3029–3039.
Petzold, G. C., Hagiwara, A. & Murthy, N. (2009). Serotonergic modulation of odor input to the mammalian olfactory bulb. National Neurosciences, 12, 784–791.
Ressler, K. J., Sullivan, S. L. & Buck, L. B. (1994). Information coding in the olfactory system: Evidence for a stereotyped and highly organised epitope map in the olfactory bulb. Cell, 79, 1245–1255.
Vosshal, L., Wong, A. & Axel, R. (2000). An olfactory sensory map in the fly brain. Cell, 102, 147–159.
Zhao, X. C. & Berg, B. G. (2009). Morphological and physiological characteristics of the serotonin-immunoreactive neuron in the antennal lobe of the male oriental tobacco budworm, Helicoverpa assulta. Journal of Chemical Senses, 34, 363–372.
Zhao, X. C. & Berg, B. G. (2010). Arrangement of output information from the 3 macroglomerular units in the heliothine moth Helicoverpa assulta: Morphological and physiological features of male-specific projection neurons. Journal of Chemical Senses, 35, 511–521.
