Strukturell MR og kognitiv funksjon: Hvordan henger endringer i hjerne og kognisjon sammen?
Kristine B. Walhovd & Anders M. Fjell
- Kristine B. Walhovd
- Anders M. Fjell
In this paper, the authors explain how changes in brain structure and cognition are related. Modern methods that analyze magnetic resonance (MR) imaging scans are able to track relatively small changes in brain structure. A combination of morphometric and diffusion tensor imaging approaches, provides the opportunity to focus on specific brain structures as well as the connections between these structures. It is therefore possible to study changes in brain structure and connectivity that result in changes in cognitive function. The authors use three models as starting points for their endeavour: development, aging, and plasticity induced by cognitive training. Changes in brain structure and changes in cognitive function are discussed, based on these three models.
Keywords: MR, cognition, memory, development, aging, plasticity
Både hjernen og våre kognitive evner endres kontinuerlig gjennom hele livet. I denne artikkelen forsøker forfatterne å forklare hvordan endringer i hjernens oppbygning kan føre til endringer i kognitiv funksjon gjennom å bruke eksempler fra utvikling, aldring og kognitiv trening.
En av de få sikre tingene i livet er forandring. Gjennom hele livsløpet er vi i kontinuerlig endring. Ser man for eksempel på enkel reaksjonstid, finner man ikke hos den enkelte et stabilt nivå. Vi blir fantastisk mye raskere fra spedbarnsalderen og opp i 20-årene, hvorpå vi blir gradvis tregere gjennom resten av livet. Et annet eksempel på endring er at kognitiv trening kan gjøre oss bedre i stand til å løse oppgaver (Jones et al., 2006). En viktig utfordring i moderne nevropsykologi og kognitiv nevrovitenskap er å forstå det nevrale grunnlaget for endring av kognitive evner. Denne artikkelen vil ta utgangspunkt i tre fenomener kjennetegnet av omveltninger i kognitive evner: utvikling, aldring og kognitiv trening. Vi vil vise hvordan endringer i hjernens struktur, målt ved MR (Magnetic Resonance Imaging, magnettomografi), henger sammen med utvikling og reduksjon i kognitive evner. Artikkelen vil gi innblikk i dagens MR-forskning rundt disse temaene, men vil på ingen måte være uttømmende. Vi vil trekke inn en del norske studier, fordi dette kan ha spesiell interesse for norske lesere. Først vil vi imidlertid kort presentere hvordan endringer i hjernens oppbygning kan studeres i levende mennesker ved hjelp av MR, og forklare litt om det nevrobiologiske grunnlaget for forholdet mellom mål på hjernestruktur og kognitive egenskaper.
Moderne teknikker for å studere menneskehjernens oppbygning
Når man ønsker å studere hjernens struktur in vivo, altså i levende mennesker, må man bruke en eller annen bildedannende teknikk. I dag vil det nesten utelukkende bety MR. Mulighet for slike undersøkelser finnes på alle større sykehus i Norge, og er sentralt i nevroradiologiske vurderinger av pasienter med mulige hjerneskader. En radiolog gjør da kvalitative vurderinger av hjernens utseende, som f.eks. å se etter svulster eller slag. Ved bruk av avansert bildebehandling, hjernemorfometri og diffusion tensor imaging (DTI) kan MR-bilder imidlertid også brukes til å gi detaljerte kvantitative beskrivelser av hjernens struktur.
Hjernemorfometri: Undersøkelse av hjernens volumetri
Morfometri dreier seg om å beregne tykkelsen på hjernebarken, og volumet av grå og hvit substans (se under) i ulike subkortikale strukturer. Dette var ikke mulig for få år siden, men en enorm metodologisk utvikling gjør at detaljerte undersøkelser av endringer i hjernens struktur nå er mulig. Figur 1 viser et eksempel på hvordan hjernebarkens tykkelse kan vises som et fargekart. Figur 2 viser bilder av hjernen der alle de tredimensjonale bildeelementene (vokslene) er klassifisert ut fra hvilken struktur de hører til. Vi kan for eksempel studere små endringer i tykkelsen på hjernebarken i områder vi tror er relevante for en spesifikk kognitiv funksjon. På figur 3 er det gitt en grov oversikt over noen av områdene i hjernebarken som det vil refereres til i artikkelen.
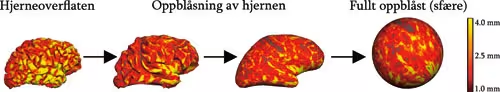
Figur 1. Tykkelsen på hjernebarken: Figuren viser hvordan tykkelsen på hjernebarken kan visualiseres som et fargekart. Vi ser at tykkelsen på hjernebarken varierer mye i ulike områ-der, men at den generelt er størst i gyriene (foldene) og minst i sulciene (furene) på hjerneoverflaten. Ved å «blåse opp» hjernen som vist på figuren kan man lettere sammenligne forskjellige hjerner, ved at alle hjernene da har samme form (en sfære).
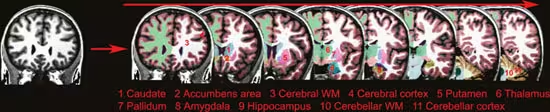
Figur 2. Subkortikal segmentering: Figuren viser hvordan det ut fra et MR-bilde er mulig å beregne volumet på hjernens strukturer. Hvert eneste tredimensjonale bildepunkt (1 kubikkmillimeter) er fargekodet og klassifisert som en av flere forskjellige hjernestrukturer.
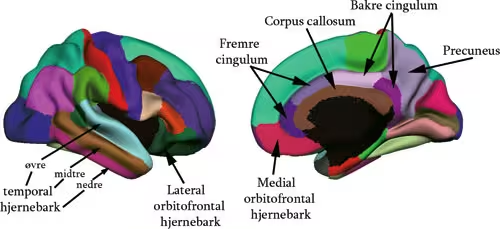
Figur 3. Områder i hjernebarken: Her vises de områ-dene av hjernebarken som omtales, og de mest sentrale i denne artikkelen er navngitt. Hjernen er et gjennomsnitt av en rekke deltageres individuelle hjerner, og den er delvis blåst opp slik at det blir lettere å se både folder (gyrier) og furer (sulcier) på hjerneoverflaten.
Slike målinger har foreløpig liten klinisk anvendelse, men vil på sikt kunne bidra til f.eks. å følge utviklingen av progredierende lidelser som Alzheimers sykdom. Et eksempel på dette ble gitt i en studie av Fischl mfl. (2002). De brukte morfometriske teknikker til å analysere MR-bilder fra en gruppe pasienter. Beregningene viste at det var mulig å predikere hvilke av pasientene som utviklet Alzheimer i løpet av de tre neste årene, og hvilke som ikke gjorde det. Denne typen kunnskap er viktig for å forstå forløpet i progredierende forstyrrelser, og dermed kunne bidra til bedre diagnostikk og behandling. Flere eksempler på bruk av morfometriske teknikker vil bli gitt under.
Diffusion Tensor Imaging (DTI): Undersøkelsen av hjernens nervebaner
MR-bilder kan tas slik at de er sensitive for vannmolekylers bevegelse (diffusjon) i hjernen. Hvis molekylene får bevege seg fritt, vil de bevege seg like mye i alle retninger, og vi sier at diffusjonen er isotropisk. I hjernen vil spesielt myelin, det fettholdige laget som isolerer nervefibre, hindre vannmolekylene i å bevege seg fritt. Dette gjør at molekylenes bevegelse vil gå mer langsmed nervefibrene enn på tvers av dem. Vi sier da at diffusjonen er anisotropisk. Graden av anisotropi kan regnes ut for hvert område i hjernen og uttrykkes gjennom en indeks, fraksjonell anisotropi (FA), som går fra 0 til 1. Hvis FA er høy, betyr det at mesteparten av vannmolekylenes egenbevegelse går langs én akse. Dette tolkes gjerne som at det er mange myeliniserte nervefibre i området. Myeliniserte nervefibre utgjør hjernens hvite substans, og er avgjørende for at de ulike områdene i hjernen skal kunne kommunisere effektivt med hverandre. DTI kan dermed gi oss informasjon om mikrostrukturen til hjernens nervefibre. Et eksempel på et DTI-bilde er gitt på figur 4.
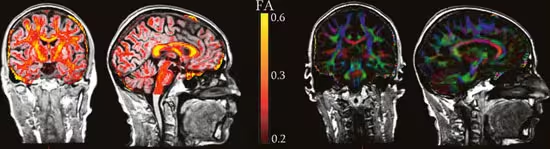
Figur 4. Diffusion Tensor Imaging: Må-ling av nervefibrene i hjernen: Eksempler på informasjon man kan få ut av et DTI-bilde. På de to bildene til venstre er FA-indeksen illustrert på en skala der gult indikerer høyest FA. Høy FA sammenfaller med de viktigste fiberbanene. I hjernene til høyre er alle bildepunktene kodet med en farge. Rødt betyr at mesteparten av vanndiffusjonen går på tvers i hjernen, blått betyr at diffusjonen går opp og ned og grønt betyr at at den går langsmed hjernen. Jo sterkere fargene er, desto sterkere er diffusjonen.
DTI er en av de nyeste imagingteknikkene, og det er store forventninger til hva DTI kan bidra med i forståelsen av hjerne-kognisjon-forhold. Vi vet at selv enkle kognitive oppgaver involverer kommunikasjon mellom en rekke forskjellige hjerneområder. Enkelte forskere har sågar argumentert for at økningen av mengden isolerte nervefibre har vært viktigere for menneskeartens kognitive evolusjon enn økningen i mengden hjernebark. Det er også foreslått at reduksjon i myeliniseringen er en generell mekanisme som kan forklare mye av nedgangen i kognitive evner med økende alder (Bartzokis et al., 2004). Dette er et spørsmål som kan belyses ved hjelp av DTI. For eksempel fant Grieve at al. (2007) nylig at reduksjoner i FA kunne bidra til å forklare nedgangen i eksekutive funksjoner (se under) med økende alder.
I tillegg til å se på hvitsubstansintegriteten ved bruk av FA kan DTI brukes til såkalt traktografi. Dette er en metode for å finne spesifikke nervebaner i hjernen. Hvis man vet at to områder i hjernebarken er viktige for en kognitiv funksjon, kan DTI brukes for å finne den mest sannsynlige nerveforbindelsen mellom disse områdene. For eksempel vet vi at hjernebarken i anterior cingulate og dorsolaterale prefrontale områder er viktig for kognitiv kontroll, og at dette er en av evnene som utvikles senest. Da kan traktografi brukes til å studere hvordan nerveforbindelser mellom disse områdene modnes, og det er mulig å se om modningen skjer parallelt med utviklingen av kognitiv kontroll. Et eksempel på bruk av traktografi er gitt på figur 5.
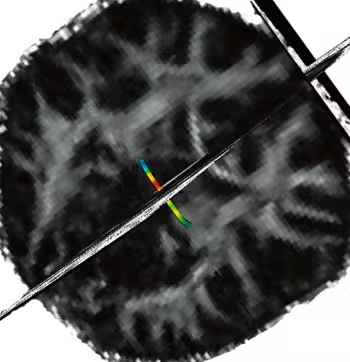
Figur 5. Traktografi: Identifisering av spesifikke nervefibre: Ved hjelp av traktografi er det mulig å identifisere spesifikke nervebaner i hjernen. Figuren viser en sti gjennom den bakre delen av corpus callosum (splenium), som er den mest sannsynlige veien mellom et gitt punkt i hver hjernehalvdel. Stien er fargekodet etter hvor høy FA-indeksen er i de ulike delene.
Forholdet mellom hjernestrukturelle forhold og kognitive funksjoner
Som vi skal gå nærmere inn på under, er det bred evidens for at endringer i spesifikke hjernestrukturer og endringer i spesifikke kognitive funksjoner går parallelt i utvikling, aldring og sykdom. Det betyr imidlertid ikke at det trenger å være noe forhold mellom individuelle forskjeller i hjernens strukturelle oppbygning og kognitive funksjoner i unge friske mennesker. Forholdet mellom generelle evner og grove mål på hjernevolum er omdiskutert, og det er klart at det finnes en rekke andre faktorer av betydning. Imidlertid har storparten av studier over de siste årene vist en sammenheng (Deary og Caryl, 1997; Wicket mfl., 2000; Witelson mfl., 2006; Walhovd mfl., 2005a). Typisk finner man korrelasjoner på rundt .40. Det er funnet noe mindre robuste forhold mellom mer spesifikke evner og spesifikke morfometriske mål. For eksempel synes hippocampusvolum ikke generelt å være assosiert med hukommelse over kortere tid (Van Petten, 2004), men over flere uker (Walhovd mfl. 2004). Dette er i samsvar med kunnskap om hippocampus’ rolle i hukommelse over lang tid. Walhovd mfl., (2006) fant videre at hukommelse over flere uker, men ikke over kort tid (<1 t) var relatert til tykkelsen på hjernebarken i områder som antas å være sentrale i et nettverk for episodiske minner (f.eks. precuneus, høyre temporale hjernebark). Dette stemmer med teorier om at konsolidering av hukommelse er en prosess som pågår over mye lengre tid (uker, måneder og år) enn det tidsintervallet som vanligvis brukes i nevropsykologiske utredninger (ca. 30 minutter).
Et viktig spørsmål blir dermed å forstå det nevrobiologiske grunnlaget for disse forholdene. Hvorfor er det en sammenheng mellom hjernestrukturer og mentale evner, og hvorfor ser mentale evner ut til å endre seg i takt med endringer i hjernestrukturer? Grunnlaget er langt fra godt forstått. Fra et enkelt «bigger is better»-synspunkt vil større hjerneområder generelt være assosiert med bedre mentale evner. Det er flere grunner til dette. Den mest umiddelbare er at store hjerner kan gi grunnlag for høyere evner fordi de generelt har flere nevroner (Pakkenberg og Gundersen, 1997) og antagelig flere forbindelser mellom nervecellene (synapser) (Wickett, Vernon og Lee, 2000). Andre forslag til hvilket nevralt grunnlag som kan forårsake en sammenheng mellom hjernestruktur og mentale evner, er kompleksiteten til nevrale kretser, hvor mange mottakspunkter (dendritter) hver nervecelle har for signaler fra andre nerveceller, hvor godt isolert nervefibrene er (tykkelsen på myelin), nevrotransmitterproduksjon og «reservekapasitet» (Deary og Caryl, 1997; Vernon mfl., 2000). En alternativ tilnærming til denne «bigger is better»-hypotesen er at intakte strukturer har normal størrelse, og strukturer av normal størrelse vil støtte normal funksjon, men at vevstap vil føre til en reduksjon i funksjon (Van Petten, 2004). Dette er etter vårt synspunkt en interessant tilnærming, idet den fokuserer på at det dynamiske forholdet mellom hjernen og kognitive funksjoner er i konstant endring. Ut fra et slikt perspektiv vil korrelasjoner mellom hjernestruktur og kognitiv funksjon finnes i f.eks. grupper av eldre heller enn yngre, eller i pasientgrupper, men ikke i grupper av friske. Dette er funnet i flere studier (f.eks. Raz, Gunning-Dixon, Head, Duputi og Acker, 1998; Fjell et al., 2007). Dette betyr også at de nevrobiologiske årsakene til sammenhengene mellom kognitiv funksjon og hjernestruktur er forskjellige i ulike grupper. For eksempel er det atrofi med tap av nevroner i ulike deler av hjernen i Alzheimer-pasienter, mens hjernene til friske på samme alder i liten grad er preget av celledød. Dette kan da bidra til å forklare volumforskjeller mellom friske kontroller og Alzheimer-pasienter. Samtidig ser vi at det foregår en reduksjon i hjernebarkens tykkelse og volumet av de fleste subkortikale strukturer med økende alder (Walhovd mfl., 2005b, c), uten at det er evidens for særlig grad av celledød hos friske eldre. Grunnlaget her kan for eksempel være variasjon i nevroners størrelse og antall forbindelser mellom nevroner (synapser). Poenget er at forskjeller i hjernebarkens tykkelse vil ha ulike nevrobiologiske årsaker avhengig av hvilke grupper vi sammenligner, og dette vil også kunne ha konsekvenser for struktur-kognisjon-forholdet.
Det finnes også sykdomstilstander der større hjerner er forbundet med lavere kognitive evner (Courchesne mfl., 1975), og det er størrelsesforskjeller i menns og kvinners hjerner som ikke gir opphav til forskjeller i kognitive evner. Studier har imidlertid vist at hos kvinner utgjør hjernebarken en relativt større andel av hjernevolumet enn hos menn, der hvitsubstans utgjør en større del (Gur et al., 1999). Dette kan være en funksjon av at større hjerner trenger flere langtrekkende og dermed isolerte nervefibre. Poenget i denne sammenhengen er uansett at selv om det finnes et forhold mellom hjernestørrelse og intelligens, så er det mange kompliserende faktorer. Konklusjonen er at struktur-kognisjons-korrelasjoner har forskjellige nevrobiologiske forklaringer i forskjellige grupper. Videre i denne artikkelen vil vi bruke utvikling, aldring og plastisitet ved kognitiv trening som modeller for å vise hvordan endringer i hjerneanatomi og endringer i kognitive evner kan skje parallelt.
Tre modeller for å undersøke hvordan strukturendringer påvirker kognitive funksjoner
Det skjer en enorm hjerneutvikling på fosterstadiet. På enkelte tidspunkter dannes 250 000 nye hjerneceller (nevroner) hvert minutt. Disse nevronene dannes i lavere deler av hjernen og må forflytte seg til sine riktige plasser. Ved fødselen er nesten alle nevroner man har i voksen alder, på plass. Likevel utgjør hjernen på dette tidspunktet «bare» om lag 1/3 av størrelsen i ung voksen alder. Hva skjer med hjernen i barne- og ungdomsår? I løpet av første leveår dobler størrelsen seg, fra om lag 400 til 800 g, og hos treåringer er allerede hjernen om lag 1,1 kg og nær voksen størrelse (Dekaban og Sadowsky, 1978). Økningen i hjernevolum skyldes bl.a. vaskulære endringer, dannelse av nye koblinger mellom hjerneceller (synaptogenese) og myelinisering av nerveforbindelsene. Enhver som har hatt anledning til å kjenne en liten go’ing over tid, kan konstatere at den hurtige hjerneutviklingen som er beskrevet her, sammenfaller med en fantastisk utvikling i adferdsmessige evner. Det er imidlertid ikke kun volumøkninger i hjernen som kjennetegner kognitiv utvikling, og MR-studier er sensitive for endringer av ulike typer.
Når mindre gir mer
Redusert grå substans hos friske eldre kan være forbundet med lett reduksjon i kognitive evner (se under). Da kan det virke paradoksalt at flere MR-studier har vist reduksjon i volum av grå substans også i barne- og ungdomsalder (f.eks. Courchesne mfl., 2000; Gogtay mfl., 2004). Det er åpenbart at en slik utvikling hos friske unge ikke henger sammen med evnereduksjon. Hva foregår? Man vet ikke eksakt hvilke prosesser som ligger til grunn. Hjernens totale hvitsubstansvolum øker frem til 40-årene (Walhovd mfl., 2005b). Dette skyldes myelinisering av forbindelsene mellom nevroner, og kan forklare noe av gråsubstansreduksjonen også hos barn og unge som en relativ reduksjon i forhold til hvit substans (Sowell mfl., 2001). Imidlertid er en viktig prosess i hjerneutviklingen også en type beskjæring, «pruning», av forbindelser mellom nevroner. Dette er en sannsynlig kandidat i de observerte fortynningene av grå substans i hjernebarken. Det dannes et enormt antall synapser tidlig i spedbarnsalderen. Overproduksjon fulgt av eliminasjon gir antagelig en spesiell mulighet til adaptasjon og kognitiv utvikling, og er et mer fremtredende trekk i høyere utviklede dyr. Mekanismene bak er ikke fullt forstått, men inkluderer genetisk programmering og konkurranse mellom forbindelsene til nevronene. De forbindelsene som blir mest brukt, styrkes, mens andre går til grunne (se for eksempel Huttenlocher, 2003). Dette indikerer at barnets tidlige erfaringer er avgjørende i å forme en hjerne i utvikling.
MR-studier som viser redusert volum av hjernebarkens grå substans i barne- og ungdomsalder (f.eks. Gogtay mfl., 2004), har naturlig blitt satt i sammenheng med histologiske studier (anatomiske studier av vev med mikroskop) som viser synapsereduksjon under utviklingen (f.eks. Huttenlocher og Dabholkar, 1997). Gogtay mfl. (2004) benyttet MR-analyser for å studere utvikling i hjernebarkens grå substans i alderen 4 - 21 år hos en gruppe barn som ble skannet annethvert år over en periode på 8 - 12 år. Samlet gråsubstansvolum økte i tidlige år, fulgt av reduksjoner omkring puberteten. Resultatene viste en sekvens av gråsubstansmodning som sammenfaller med kjente milepeler i kognitiv og sensorimotorisk utvikling (kan sees som en video: http://www.pnas.org/cgi/content/full/0402680101/DC1). Høyere ordens assosiasjonsområder av hjernebarken modnet etter lavere ordens somatosensoriske og visuelle områder: Områder i hjernen som er involvert i høyere ordens kognitive oppgaver, kan ikke utvikles før områder involvert i lavere kognitive oppgaver er på plass. Dermed vil f.eks. hjerneområder som er involvert i sansning og tidlig persepsjon, utvikles før assosiasjonsområder som viderebehandler informasjonen fra de primære persepsjonsområdene. Frontale deler av hjernebarken modnes bakfra og fremover med økende alder. Med andre ord er fremre områder av frontallappene som styrer komplekse eksekutive funksjoner, sent ute.
Et eksempel: prenatal rusmiddeleksponering
MR-morfometriske studier er som vist over svært sensitive for normal hjerneutvikling. De siste årene har også vist at MR er et sensitivt redskap i deteksjon av små endringer i hjerneutviklingen. Et felt der MR-studier har belyst nevralt grunnlag for nevropsykologiske problemer, er prenatal rusmiddeleksponering. Som nevnt over foregår en fantastisk hjerneutvikling på fosterstadiet, og ved fødselen er nesten alle nevroner man har i voksen alder, allerede på plass. Dette gjør dessverre små personer svært sårbare for virkning av giftstoffer under svangerskapet. Nevropsykologiske problemer er vanligere hos barn utsatt for rusmidler under svangerskapet, og MR-studier har dokumentert hjerneabnormaliteter som kan utgjøre et grunnlag for disse vanskene. Mest studert er barn med føtalt alkoholsyndrom (FAS), der man har funnet generelt mindre hjernevolumer, og spesielt reduksjon i basalgangliene, hjernebjelken (corpus callosum) og lillehjernen (Riley & McGee, 2005). Nylig har også barn utsatt for polysubstansmisbruk, inkludert opiater, under svangerskapet blitt studert med MR-morfometri. I en stor norsk studie er det dokumentert at disse barna som gruppe i snitt viser mer distraherbarhet og lavere perseptuelle utføringsskårer enn en kontrollgruppe, også under adekvate oppvekstforhold (Moe, 2002; Moe og Slinning, 2002; Slinning, 2004). Ved MR-morfometri da barna var rundt 11 år, ble det funnet relativt lette, men signifikante reduksjoner i flere hjerneområder enn hos barn uten slik belastning (Walhovd mfl., 2007). Gruppeforskjellene gjaldt en rekke subkortikale hjernestrukturer, og hos opiateksponerte barn utmerket pallidum og putamen seg spesielt som mindre. I tillegg ble det funnet signifikant tynnere hjernebark i anterior cingulate og et lateralt orbitofrontalt område. Sistnevnte område er involvert i responsinhibisjon (Elliott et al., 2000), og hjernebarkens tykkelse her var hos barna relatert til «frihet fra distraherbarhet», en faktor som omfatter deltestene regning, tallspenn og koding i WISC-R (Wechsler Intelligence Scale for Children - Revised, Wechsler, 1974). Man kan ikke trekke svært sterke konklusjoner basert på et lite utvalg (n = 28) der flere forhold enn opiateksponering i seg selv varierer systematisk med gruppe. Funnene beskrevet over forble imidlertid signifikante også når svangerskapslengde, kjønn og alder ble statistisk kontrollert for, og kan derfor være resultat av små utviklingsforandringer i hjernen ved rusmiddeleksponeringen. Funnene er også meningsfylte tatt i betraktning at barn med denne type belastning typisk kan oppleve oppmerksomhetsvansker og hyperaktivitet. En fremtredende hypotese er at ADHD innbærer strukturelle og funksjonelle hjerneabnormaliteter i frontal-striatale kretser, og det er mye empirisk støtte for dette (se Seidman mfl., 2005). Anterior cingulate, prefrontale områder og pallidum og putamen har alle en rolle i frontal-striatale kretser som i ulike studier har blitt implisert i ADHD. For eksempel har slag i putamen, sammenlignet med andre fokale skader, blitt assosiert med økt risiko for symptomer på oppmerksomhetssvikt og hyperaktivitet (Max mfl., 2002), og ved en litteraturgjennomgang fant Seidman mfl. (2005) at alle fire MR-studier av pallidumvolum i ADHD rapporterte mindre volumer hos barn med denne diagnosen. Det var høynet forekomst av ADHD og relaterte problemer i det aktuelle utvalget av norske polysubstanseksponerte barn, indikert ved høynet diagnoserate (4 av 14) og forhøyede problemskårer på Child Behavior Checklist (CBCL).
Aldring
Mange kognitive funksjoner, f.eks. hukommelse, prosesseringshastighet, eksekutive funksjoner og visuell resonnering, blir dårligere med høyere alder. Selv om det også er enkelte kognitive evner som er lite påvirket av alder, f.eks. verbale evner, må nedgangen i de fleste kognitive funksjoner ha et grunnlag i relativt store endringer i hjernens struktur. Ved hjelp av MR er det etablert at tykkelsen på hjernebarken minker med økende alder, at mengden av myeliniserte nervefibre reduseres, og at mengden cerebrospinalveske øker. I en norsk studie (Walhovd et al., 2005b) ble det funnet at alder korrelerte -.78 med volumet på hjernebarken, -.51 med hvitsubstans og .70 med størrelsen på lateralventriklene (væskefylte rom i hjernen). Eksempler er illustrert på figur 6. Av 16 hjernestrukturer som ble undersøkt, var det kun to som bare var marginalt relatert til alder (pallidum og 4. ventrikkel). Lignende resultater er funnet i andre studier, og både kryss-seksjonelle og longitudinelle studier har vist relativt store effekter av alder på hjernevolum. Interessant nok er det forskjeller i hvordan de ulike hjernestrukturene påvirkes av alder. I hjernebarken totalt sett ser det ut til å være en lineær nedgang i volum med alderen, dvs at hjernebarken reduseres i volum omtrent like mye hvert år. I motsetning til dette viser det seg at hjernens hvite substans fortsetter å øke frem til 40 - 50-årene før volumet begynner å synke. Dette kan indikere at prosessene som isolerer nervefibre, er trege, og at de ulike hjerneområdenes evne til å kommunisere med hverandre utvikles gjennom store deler av livet. I så fall vil vi kunne forvente at enkelte kognitive evner også ville forbedres frem til 40 - 50-årene, men dette er ikke klart påvist. Det kan tenkes at det er et samspill mellom utvikling av hvitsubstansen og fortynning av hjernebarken som til sammen skaper en effekt på kognitive evner (Walhovd et al., 2005c). George Bartzokis argumenterer for at nevrale kretser som kontrollerer motorisk aktivitet, begynner å demyeliniseres allerede i 30-årsalderen, noe som bl.a. kan bidra til å forklare aldersrelaterte reduksjoner i reaksjonstid. I motsetning til dette hevder han at områder som er involvert i høyere resonnering, først er fullt ut myelinisert hos middelaldrende, og at dette gjør at vi tar bedre beslutninger senere i livet enn når vi er unge: «Fifty is when we’re fully myelinated and our intellectual powers soars» (intervju i Discover, Spring 2007, s. 14).
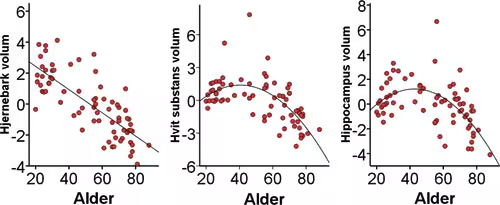
Figur 6. Alderseffekter på volumet av hjernebarken, hvitsubstans og hippocampus: Figuren viser hvordan volumet på hjernebark, hvitsubstans og hippocampus endres. Som man kan se, endres noen deler av hjernen med alderen på en lineær måte, mens andre deler bruker lang tid på å nå sitt maksimale volum, før reduksjonen begynner. Figuren er en omarbeidet versjon av figur 2 fra Walhovd et al. (2005).
Andre studier har vist at ulike områder av hjernebarken påvirkes forskjellig av alder (f.eks. Salat et al., 2004). Et eksempel på dette er vist på figur 7. Slike studier har gitt en viss støtte til den såkalte «last in - first out»-hypotesen. Ifølge den vil de områdene av hjernen som utvikles senest hos barn og ungdom, også være de første som påvirkes av aldersendringer i den andre delen av livsløpet. Den kanskje siste gruppen av funksjoner som vil utvikles, og dermed også den første til å påvirkes av aldersendringer, er eksekutive funksjoner, som støttes av områder i prefrontal hjernebark. Studier som har sett på effekten av alder på hjernebarken, har gitt noe støtte til dette synet, ved å vise fortynning i fremre deler av hjernen. Samtidig er det klart at alderseffektene er tydelige i store deler av hjernebarken, og langt fra begrenset til frontale områder. Dette kommer klart frem av figur 7.
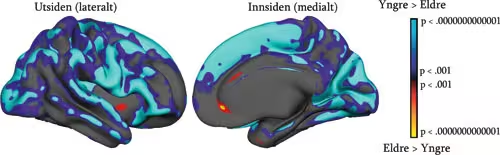
Figur 7. Alderseffekter på tykkelsen av hjernebarken: Figuren viser hvilke områ-der i høyre hjernehalvdel som fortynnes (blått-grønt), og hvilke som øker i tykkelse (rødt-gult) med økende alder. Vi ser at fortynning skjer i store deler av hjernebarken. Denne analysen er basert på de første 494 deltagerne i en stor multisenter-studie av alderseffekter på hjernen, ledet fra Psykologisk Institutt, UiO.
En annen struktur som reduseres i volum i høy alder, er hippocampus (se figur 8). Hippocampus er spesielt viktig for lagring av episodiske minner, det vil si minner som utgjør vår personlige historie. De berømte studiene av pasienten H.M., som fikk hippocampus fjernet på begge sider, har vist at hippocampus er nødvendig for at minner skal feste seg i hjernen. Med dårligere funksjon av hippocampus vil det bli vanskeligere å huske ny informasjon, og også informasjon man har lært i løpet av de siste årene, vil være vanskelig å huske. En del forskere mener at episodiske minner alltid vil være avhengige av at hippocampus fungerer, og at de gradvis vil forringes hvis hippocampus slutter å fungere. I den norske studien referert ovenfor ble det funnet at hippocampus ble redusert i størrelse med 13,6 % fra 20 til 90 år. Når vi samtidig vet at episodisk hukommelse, som er avhengig av hippocampus, forringes med økende alder, kan det tenkes at endringene i hippocampusvolum er delvis ansvarlig for reduksjonene i hukommelsesevner.
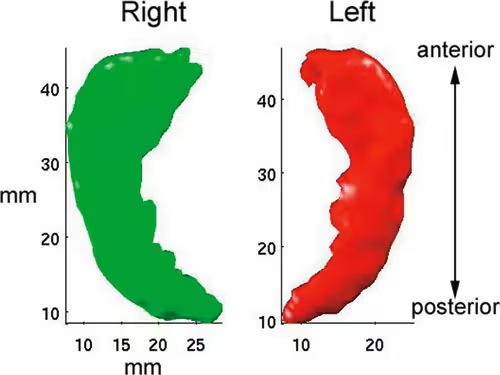
Figur 8. Segmentering av hippocampus: Basert på en MR-skanning kan volumet på ulike hjernestrukturer regnes ut. Dette er eksempel på en tredimensjonal rekonstruksjon av hippocampus. Segmenteringen er basert på programvaren Freesurfer, og Arvid Lundervold har brukt denne for å konstruere en tredimensjonal figur.
Som tidligere nevnt er de myeliniserte nervebanene i hjernen nødvendige for høyere kognitiv funksjon, og det er mulig at endringer i isoleringen av disse nervefibrene er delvis ansvarlige for både aldersrelaterte endringer i kognisjon og individuelle forskjeller i mentale evner. En DTI-studie av Salat et al. (2005) viste for eksempel at FA-indeksen gikk ned med økende alder i store deler av hjernen, spesielt i frontale områder. Dette passer godt med frontallappsteorien og «last in first out»-teoriene om kognitiv aldring. Det ble som nevnt ovenfor funnet direkte støtte for denne teorien av Grieve at al. (2007), som viste at reduksjoner i FA kunne bidra til å forklare aldersnedgangen i eksekutive funksjoner.
En stor debatt innenfor nevrovitenskapelig forskning på livsløps- og aldersutvikling er knyttet til spørsmålet om bevaring vs. kompensasjon. Fundamentalt sett kan man spørre: Vil optimal kognitiv aldring være kjennetegnet av bevaring og bruk av de samme nevrale mekanismene for å løse en kognitiv oppgave som da man var ung, eller er det mer hensiktsmessig å bruke nye nevrale strukturer for å løse de samme oppgavene etter som de opprinnelige strukturene begynner å forfalle? Hvis det første er sant, vil vi forvente at eldre med høyt funksjonsnivå bruker de samme delene av hjernen som unge for å løse et problem, mens eldre med lavere funksjon vil bruke andre deler. Hvis det andre er sant, vil eldre med høy funksjon bruke andre eller flere hjerneområder enn yngre for å løse en gitt oppgave, mens eldre med lavere funksjonsnivå vil bruke de samme områdene som de unge. Cabeza og kolleger (2002) har gitt evidens i favør av den siste forklaringen. De brukte positronemosjonstomografi (PET) mens unge og eldre deltagere gjorde en hukommelsesoppgave. Det viste seg at de eldre som fungerte dårligst, brukte de samme hjerneområdene for å utføre oppgaven som unge, mens de eldre som fungerte best, i tillegg brukte andre hjerneområder. Dette ble tolket til inntekt for kompensasjonshypotesen: for å opprettholde optimal kognitiv funksjon i høy alder må man rekruttere andre nevrale områder enn dem som brukes av unge. Hvis dette stemmer, vil det være rimelig å forvente at eldre med høyt versus mer normalt funksjonsnivå vil skille seg fra hverandre også i hjernestruktur. I en norsk studie (Fjell et al., 2006) ble det funnet at eldre med høyt kognitivt funksjonsnivå hadde tykkere hjernebark i spesielt ett område (posterior cingulate cortex) enn eldre med mer gjennomsnittlig kognitiv fungering (se figur 9). Posterior cingulate er involvert i overordnet oppmerksomhet, integrering av og resonnering om relasjoner mellom stimuli, og er del av et nevralt nettverk for episodisk hukommelse (Kroger et al., 2002; Posner og Petersen, 1990; Buckner et al., 2004). Denne forskjellen ble ikke funnet når høytfungerende unge ble sammenlignet med normaltfungerende unge. Evidensen indikerte at å opprettholde et høyest mulig kognitivt nivå gjennom livet primært innebar å bevare hjernestrukturer best mulig, men det ble også funnet evidens for at fortykning i dette spesifikke området var assosiert med høy funksjon hos eldre. Disse funnene er i samsvar med et dynamisk syn på forholdet mellom hjernestruktur og -funksjon, som sier at strukturer av normal størrelse vil støtte normal funksjon, men at vevstap vil føre til en reduksjon i funksjon, og kanskje at volumøkninger vil kunne gi bedret kognitiv funksjon. Dette bringer oss over på spørsmålet om i hvilken grad intensiv kognitiv trening kan føre til strukturelle endringer i hjernen som er så store at det kan måles ved hjelp av MR. Kan et forhold mellom hjernestruktur og hjernefunksjon oppstå som en følge av at kognitiv trening bedrer funksjon gjennom fortykning av spesifikke deler av hjernebarken?
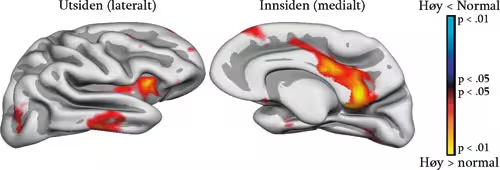
Figur 9. Segmentering av hippocampus: Basert på en MR-skanning kan volumet på ulike hjernestrukturer regnes ut. Dette er eksempel på en tredimensjonal rekonstruksjon av hippocampus. Segmenteringen er basert på programvaren Freesurfer, og Arvid Lundervold har brukt denne for å konstruere en tredimensjonal figur.
Potensial for endring: plastisitet
Plastisitet har blitt et sentralt begrep i kognitiv nevrovitenskap, og refererer ofte til fysiske sentralnervøse endringer som ligger til grunn for læring eller tilpasning til miljømessige endringer, også antatt viktig i funksjonsøkninger ved bedring etter hjerneskade (Kolb og Wishaw, 2005; Gazzaniga mfl., 2002). Man har naturlig anerkjent at det er enorme sentralnervøse endringer i tidlig utvikling, men det har inntil relativt nylig vært en tendens til å anse den voksne hjernen som ganske rigid (Gazzaniga mfl., 2002). I dag har vi imidlertid, selv om aldring er forbundet med begrensninger i læring og potensial for endring, også evidens som indikerer plastisitet gjennom hele livsløpet (Jones et al., 2006). I de siste årene har det kommet rapporter fra MR-morfometristudier som indikerer at hjernen faktisk har evne til å endre form og volum i løpet av relativt kort tid som resultat av erfaring og trening. En tidlig studie som av flere ble tatt til inntekt for erfaringsbasert strukturell plastisitet, var Maguire mfl.s (2000) rapport om hippocampusvolum hos taxisjåfører i London. Ikke bare var bakre del av hippocampus, som har blitt knyttet til navigasjonsferdigheter, større hos taxisjåførene, men volumet her var positivt relatert til sjåførenes fartstid. Maguire og kollegaer konkluderte med at dette tydet på kapasitet for lokal plastisk strukturell endring i den friske voksne hjernen som respons på miljømessige krav. Studien var viktig, men det kunne ikke utelukkes en seleksjonseffekt i det at sjåfører med størst hippocampus kan ha vært de som holdt lengst i yrket.
Den første longitudinelle studien på strukturell plastisitet ble publisert i 2004 av Draganski mfl. Deltagerne trente på sjonglering i tre måneder, og ble undersøkt med MR før og etter treningsperioden. Etter tre måneders sjonglering fant man signifikante økninger i hjernebarkens gråsubstans midt-temporalt i begge hjernehalvdeler, samt i et venstresidig parietalt område. Disse områdene av hjernebarken ansees som bevegelsessensitive. Etter en ny tremåneders periode uten sjongleringen var tykkelsen redusert igjen. Denne studien viste til observert endring, ikke bare indviduelle forskjeller, og har vakt mye oppsikt. Funnene gir også mulighet for nye tolkninger av individuelle forskjeller i andre MR-studier. For eksempel er det, som omtalt over, påvist tykkere hjernebark i posterior cingulate hos eldre som opprettholder et høyt funksjonsnivå, som målt ved høye utføringsevner (Fjell et al., 2006). Sett i lys av Draganski mfl.s (2004) funn kan man spekulere i om aktiv bruk av denne strukturen, kanskje kompenserende for andre aldersendringer, kan ha endret det nevrale aldersforløpet og ført til volumøkninger. Nylig har Draganski mfl. (2006) også vist at mental trening, i form av intensive eksamensforberedelser, ga volumenringer i hippocampus og tykkere hjernebark i parietale områrder. Det er det dessverre ingen som kan svare sikkert på hva disse endringene består i.
Konklusjon og videre forskning
Strukturell MR er et av de mest lovende felter i klinisk nevrovitenskap (May og Gaser, 2006); det er et unikt redskap for å studere levende hjerner i utvikling og endring. Det som observeres, kan, som vist i denne artikkelen, kobles til sikre endringer i kognisjon og adferd, og MR-morfometri vil bli en viktig metode i hjernestudier, oppfølging av sykdom og terapeutiske intervensjoner. Imidlertid trenger vi kunnskap om hva strukturell plastisitet påvist med MR består av på cellulært og histologisk nivå (May og Gaser, 2006; Draganski, 2004). Forhåpentlig vil dyremodeller kunne bidra til slik kunnskap i nær fremtid. Vi vet at nye nevroner dannes i hippocampus også hos voksne (Eriksson mfl., 1998), men det virker lite sannsynlig at dannelse av nye nevroner kan gi grunnlag for volumøkningene i hjernebarken som er omtalt over (Bhardwaj mfl., 2006). Bruksavhengige endringer i styrken og strukturen til nevrale forbindelser er fundamentale i læring (Trachtenberg mfl., 2002; Maviel mfl., 2004), og det virker mer sannsynlig at dette kan være del av grunnlaget for strukturelle MR-endringer i hjernebarken. Videre forskning på dette feltet er av stor betydning. Ved Psykologisk institutt, Universitetet i Oslo, er flere MR-prosjekter nå i gang, blant annet på plastisitet. Studiene omfatter prediksjon og kartlegging av endring med MR-morfometri ved ulike treningsopplegg hos velfungerende voksne, personer med svært lette hukommelsesvansker, og pasienter med traumatiske hodeskader. Vi går en spennende fremtid i møte.
Referanser
Bartzokis, G., Sultzer, D., Lu, P. H., Nuechterlein, K. H., Mintz, J. and Cummings, J. L. (2004). Heterogeneous age-related breakdown of white matter structural integrity: implications for cortical «disconnection» in aging and Alzheimer's disease. Neurobiology of Aging, 25, 843 - 851.
Bhardwaj, R. D., Curtis, M. A., Spalding, K. L., Buchholz, B. A., Fink, D., Björk-Eriksson, T., Nordborg, C., Gage, F. H., Druid, H., Eriksson, P. S. and Frisén, J. (2006). Neocortical neurogenesis in humans is restricted to development. Proceedings of the National Academy of Science USA, 103, 12564 - 12568.
Buckner, R. L. (2004). Memory and Executive Function in Aging and AD: Multiple Factors that Cause Decline and Reserve Factors that compensate. Neuron, 44, 195 - 208.
Cabeza, R., Anderson, N.D., Locantore, J.K., McIntosh, A.R., 2002. Aging gracefully: compensatory brain activity in highperforming older adults. NeuroImage, 17, 1394 - 1402.
Courchesne, E., Chisum, H. J., Townsend, J., Cowles, A., Covington, J., Egaas, B., et al. (2000). Normal brain development and aging: Quantitative analysis at in vivo MR imaging in healthy volunteers. Radiology, 216, 672 - 682.
Deary, I. J. and Caryl, P. G. (1997). Neuroscience and human intelligence differences. Trends in Neuroscience, 20, 365 - 371.
Dekaban, A. S., Sadowsky, D. (1978). Changes in brain weights during the span of human life: relation of brain weights to body heights and body weights. Annals of Neurology, 4, 345 - 356.
Draganski, B., Gaser, C., Busch, V., Schuierer, G., Bogdahn, U., May, A. (2004). Neuroplasticity: Changes in grey mater induced by training. Nature 427, 311 - 312.
Draganski, B., Gaser, C., Kempermann, G., Kuhn, H.G., Winkler, J., Buchel, C., May, A. Temporal and spatial dynamics of brain structure changes during extensive learning. Journal of Neuroscience, 26, 6314 - 6317, 2006.
Elliott, R., Dolan, R.J., Frith, C.D. (2000). Dissociable functions in the medial and lateral orbitofrontal cortex: evidence from human neuroimaging studies. Cerebral Cortex, 10, 308 - 317.
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A. and Gage, F. H. (1998). Neurogenesis in the adult human hippocampus. Nature Medicine, 4, 1313 - 1317.
Fischl, B., Salat, D.H., Busa, E., Albert, M., Dieterich, M., Haselgrove, C., van der Kouwe, A., Killiany, R., Kennedy, D., Klaveness, S., Montillo, A., Makris, N., Rosen, B., Dale, A. M., 2002. Whole brain segmentation. Automated labeling of neuroanatomical structures in the human brain. Neuron, 33, 341 - 355.
Fjell, A. M., Wahovd, K. B., Fischl, B; Reinvang, I. (2007). Cognitive function, P3a/ P3b brain potentials, and cortical thickness in aging. Human Brain Mapping, 28, 1098-1116.
Fjell, A. M., Wahovd, K. B., Reinvang, I., Lundervold, A., Salat, D., Quinn,B., T., Fischl, B., and Dale,A. M. (2006). Selective increase of cortical thickness in high-performing elderly-structural indices of optimal cognitive aging. NeuroImage, 29, 984 - 94.
Gazzaniga, M. S., Ivry, R. B. and Mangun, G. R. (2002). Cognitive Neuroscience: the Biology of the Mind - 2nd ed. New York: W. W. Norton & Company, Inc.
Grieve, S. M., Williams, L. M., Paul, R. H., Clark, C. R. and Gordon E. (2007). Cognitive aging, executive function, and fractional anisotropy: A diffusion tensor MR imaging study. American Journal of Neuroradiology, 28, 226 - 235.
Gogtay, N., Giedd, J. N., Lusk, L., Hayashi, K., M., Greenstein, D., Vaituzis, A. C., Nugent, T., F., 3rd., Herman, D. H., Clasen, L. S., Toga, A., W., Rapoport, J. L. and Thompson, P. M. (2004). Dynamic mapping of human cortical development during childhood through early adulthood. Proceeding of the National Academy of Science USA, 101, 8174 - 8179.
Gur, R. C., Turetsky, B. I., Matsui, M., Yan, M., Bilker, W., Hughett, P., et al. (1999). Sex differences in brain gray and white matter in healthy young adults: Correlations with cognitive performance. Journal of Neuroscience, 19, 4065 - 4072.
Huttenlocher, P. R. (2003). Basic neuroscience research has important implications for child development. Nature neuroscience, 6, 541.
Huttenlocher, P. R., Dabholkar, A. S. (1997). Regional differences in synaptogenesis in human cerebral cortex. The journal of comparative neurology, 387, 167 - 178.
Jones, S., Nyberg, L., Sandblom, J., Neely, A. S., Ingvar, M., Petersson, K. M., Bäckman, L. (2006). Cognitive and neural plasticity in aging: General and task-specific limitations. Neuroscience and Biobehavioral Reviews 30, 864 - 871.
Kolb, B., and Wishaw, I. Q. (2005). An introduction to brain and behavior - 2nd ed. New York: Worth Publishers.
Kroger, J. K., Sabb, F.W., Fales, C. L., Bookheimer, S. Y., Cohen, M. S., Holyoak, K. J. (2002). Recruitment of anterior dorsolateral prefrontal cortex in human reasoning: a parametric study of relational complexity. Cerebral Cortex, 112, 477 - 485.
Maguire, E. A., Gadian, D. G., Johnsrude, I. S., Good, C. D., Ashburner, J., Frackowiak, R. S., Frith, C. D. (2000). Navigation-related structural change in the hippocampi of taxi drivers. Proceedings of the National Academy of Science U S A, 97, 4414 - 4416.
Maviel, T., Durkin, T. P., Menzaghi, F. and Bontempi, B. (2004). Sites of neocortical reorganization critical for remote spatial memory. Science, 305, 96 - 99.
Max, J. E., Fox, P. T., Lancaster, J. L., Kochunov, P., Mathews, K., Manes, F. F., Robertson, B. A., Arndt, S., Robin, D. A., and Lansing, A. E. (2002). Putamen lesions and the development of attention-deficit/hyperactivity symptomatology. Journal of the American Academy of Child and Adolescent Psychiatry, 41, 563 - 571.
May, A. and Gaser, C. (2006). Magnetic resonance-based morphometry: a window into structural plasticity of the brain. Current Opinion in Neurology, 19, 407 - 411.
Moe, V. (2002). Foster-placed and adopted children exposed in utero to opiates and other substances: prediction and outcome at four and a half years. Developmental and Behavioral Pediatrics, 23, 330 - 339.
Moe, V., Slinning, K. (2002). Prenatal drug exposure and the conceptualization of long-term effects. Scandinavian Journal of Psychology, 43, 41 - 47.
Pakkenberg, B., and Gundersen, H. J. G. (1997). Neocortical neuron numbers in humans: Effect of sex and age. Journal of Comparative Neurology, 384, 312 - 320.
Posner, M. I., Petersen, S. E. (1990). The attention system of the human brain. Annual Review of Neuroscience, 13, 25 - 42.
Raz, N., Gunning-Dixon, F. M., Head, D., Dupuis, J. H., & Acker, J. D. (1998). Neuroanatomical correlates of cognitive aging, Evidence from structural magnetic resonance imaging. Neuropsychology, 12, 95 - 114.
Riley, E. P., and McGee, C.L. (2005). Fetal alcohol spectrum disorders: an overview with emphasis on changes in brain and behavior. Experimental and Biological Medicine, 230, 357 - 365.
Salat, D. H., Buckner, R. L., Snyder, A. Z., Greve, D. N., Desikan, R. S., Busa, E., Morris, J. C., Dale, A. M. and Fischl, B. (2004). Thinning of the cerebral cortex in aging. Cerebral Cortex, 14, 721 - 730.
Salat, D. H., Tuch, D. S., Greve, D. N., Kouwe, A. J. W., Hevelone, N. D., Zaleta, A. K., Rosen, B. R., Fischl, B., Corkin, S., Rosas, H. D. and Dale, A. M. (2005). Age-related alterations in white matter microstructure measured by diffusion tensor imaging. Neurobiology of Aging, 26, 1215 - 1227.
Seidman, L. J., Valera, E.M., Makris, N. (2005). Structural brain imaging of attention-deficit/hyperactivity disorder. Biological Psychiatry, 57, 1263 - 1272.
Slinning, K. (2004). Foster placed children prenatally exposed to polysubstances. Attention-related problems at ages 2 and 4 1/2. European Child and Adolescent Psychiatry, 13, 19 - 27.
Sowell, E. R., Trauner, D. A., Gamst, A., Jernigan, T. L. (2001). Development of cortical and subcortical brain structures in childhood and adolescence: a structural MRI study. Developmental Medicine & Child Neurology, 44, 4 - 16.
Trachtenberg, J.T., Chen, B.E., Knott, G. W., Feng, G., Sanes, J. R., Welker, E. and Svoboda, K. (2002) Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature, 420, 788 - 794.
Van Petten, C. (2004). Relationship between hippocampal volume and memory ability in healthy individuals across the lifepsan: Review and meta-analyses. Neuropsychologia, 42, 1394 - 1413.
Vernon, P. A., Wickett, J. C., Bazana, P. G. and Stelmack, R. M. (2000). The neuropsychology and neurophysiology of human intelligence. I: R. J. Sternberg (red.), Handbook of intelligence (pp. 245 - 264). New York: Cambridge University Press.
Walhovd, K. B., Moe, V., Slinning, K. P., Due-Tønnessen, P., Bjørnerud, A., Dale, A. M., van der Kouwe, A., Quinn, B. T., Kosofsky, B., Greve, D., and Fischl, B. (2007). Volumetric cerebral characteristics of children exposed to opiates and other substances in utero. NeuroImage, 36, 1331 - 1344.
Walhovd, K. B., Fjell, A. M., Dale,A. M., Fischl,B., Quinn,B. T., Makris,N., Salat,D. and Reinvang, I. (2006). Regional cortical thickness matters in recall after months more than minutes. NeuroImage, 31, 1343 - 1351.
Walhovd, K. B., Fjell, A. M., Reinvang, I., Lundervold, A., Fischl, B., Salat, D., Quinn,B. T., Makris,N. and Dale,A. M. (2005a). Cortical volume and speed-of-processing are complementary in prediction of performance intelligence. Neuropsychologia, 43, 704 - 713.
Walhovd, K. B., Fjell, A. M., Reinvang, I., Lundervold, A., Dale,A. M., Eilertsen, D. E., Quinn,B. T., Salat, D., MakrisN. and Fischl, B. (2005b). Effects of age on volumes of cortex, white matter and subcortical structures. Neurobiology of Aging, 26, 1261 - 1270.
Walhovd, K. B., Fjell, A. M., Reinvang, I. Lundervold, A., Dale,A.M., Quinn,B. T. Salat, D., Makris, N., Fischl, B. (2005c). Neuroanatomical aging: Universal but not uniform. Neurobiology of Aging, 26, 1279 - 1282.
Walhovd, K. B., Fjell, A. M., Reinvang, I., Lundervold, A., Fischl, B., Quinn, B. T. and Dale, A. M. (2004). Size does matter in the long run - Hippocampal and cortical volume predict recall across weeks. Neurology, 63, 1193 - 1197.
Wechsler, D. (1974).Wechsler Intelligence Scale for Children—Revised. The Psychological Corporation, New York.
Wickett, J. C., Vernon, P. A., and Lee, D. H. (2000). Relationships between factors of intelligence and brain volume. Personality and Individual Differences, 29, 1095 - 1122.
Witelson, S. F., Beresh, H., and Kigar, L. (2006). Intelligence and brain size in 100 postmortem brains: sex, lateralization and age factors. Brain, 129, 386 - 398.Vitenskap og psykologi
