Funksjonell magnetresonansavbildning (fMRI) av hjernen: prinsipper og klinisk anvendelse
Kenneth Hugdahl1, Maria Stylianou Korsnes2 & Karsten Specht
- Kenneth Hugdahl1
- Maria Stylianou Korsnes2
-
Karsten Specht
* Medforfatterne har bidratt like mye til utforming av manuskriptet.
karsten.specht@psybp.uib.no
In this article the authors describe how functional magnetic resonance imaging (fMRI) can be applied to brain activation related to cognitive processing. The physical and physiological principles behind fMRI are explained, as well as the principles behind analysis, visualisation and interpretation of fMRI data. The authors discuss issues related to spatial and temporal resolution in fMRI registration, and how fMRI responses are related to underlying neuronal activity and metabolism. A brief historical review on the use of fMRI in Norway is presented, with special emphasis upon the application of fMRI in the fields of neuropsychology and psychiatry. Examples are presented that illustrate how fMRI can be used to investigate auditory hallucinations in schizophrenia and epilepsy. The authors also explain how fMRI can contribute to the understanding of neuronal foundation for language processing and brain lateralization, with application to dyslexia. Examples from both national and international research are presented.
Keywords: functional magnetic resonance imaging, fMRI, schizophrenia, dyslexia, epilepsy, neuropsychology
Artikkelen beskriver noen sentrale forskningsprosjekter i Norge der funksjonell magnetresonansavbildning (fMRI) blir brukt, med vekt på nevropsykologiske undersøkelser av kognitiv funksjon ved schizofreni og dysleksi.
Hjernen består av rundt hundre milliarder nevroner, som alle står i kontakt med hverandre gjennom elektrokjemiske impulser, aksjonspotensialer og synaptiske kontakter. Nevronene krever kontinuerlig tilførsel av oksygen og glykose for å kunne sende og motta nerveimpulser. Dette kalles den nevronale metabolisme, der oksygen og glykose blir omdannet til energi for nevronene i en serie komplekse biokjemiske prosesser, som utgjør nevronenes metabolisme. Både oksygen og glykose transporteres via blodbanene til hjernen, der det ekstraheres av nervecellene. Ved utførelse av spesifikke mentale oppgaver (uansett om disse involverer sensoriske/motoriske funksjoner eller mer komplekse kognitive/emosjonelle funksjoner) aktiveres spesifikke populasjoner av nevroner. Dette medfører en redistribusjon av blodforsyningen til disse områdene i hjernen, da nevronene vil kreve øket tilførsel av oksygen og glykose som en konsekvens av en økning i den nevronale metabolismen. Funksjonell magnetresonansavbildning (på engelsk functional Magnetic Resonance Imaging, fMRI) er sensitiv for endring i oksygenekstraksjonen hos nevronene og gir derved forskeren og klinikeren en indirekte, men unik mulighet til å registrere og visualisere regional endring i blodgjennomstrømming i de delene av hjernen som krever økt tilførsel av oksygen ved kognitiv anstrengelse (for å forenkle vil vi kalle alle typer av mentale oppgaver, også sensoriske og motoriske, for kognitive oppgaver eller kognitiv anstrengelse). fMRI er således spesifikt sensitiv for endring i tilførsel av oksygen til nevronene. En annen teknikk er Positron Emission Tomography (PET), som er sensitiv for endring i glykosebehovet i hjernen som markerer nevronal aktivitet. Både fMRI og PET måler eller registrerer derfor endring i parametere som er relatert til den nevronale metabolismen. En kaller derfor begge teknikkene hæmodynamiske avbildningsteknikker, for å signalisere at de avbilder endring over tid (dynamisk) i nevronenes funksjonsnivå knyttet til ekstraksjon av stoffer som transporteres i blodet (hæmo) (se Huettel et al., 2005; Moonen & Bandettini, 1999; Cherry & Phelps, 2002 for introduksjon til fMRI og PET). Både fMRI og PET er derfor indirekte metoder i den betydning at forskeren ikke direkte måler nevronenes elektrokjemiske impulser, men endring i blodgjennomstrømming regionalt som en indikator på temporær endring i nevronenes funksjonsnivå. Dette er i kontrast til elektrofysiologiske metoder som EEG, ERP og MEG, som alle er såkalte direkte metoder, da de registrerer endring i frekvens av elektriske impulser mellom nevronene. Fordelen med de hemodynamiske metodene, og spesielt fMRI (vi vil i fortsettelsen kun diskutere fMRI, da PET ennå ikke er fullt ut etablert i Norge), er at de i motsetning til EEG-metoder klarer å vise hvor i hjernen endringen skjer, slik at forskeren kan lokalisere ulike kognitive funksjoner til spesifikke områder i hjernen. Dette prinsippet, som kalles regional lokalisering, har revolusjonert nevrovitenskapen, da det nå for første gang er mulig å spesifisere hvilke områder i hjernen (populasjoner av nærliggende nevroner) som utfører ulike kognitive oppgaver i den intakte, normalt fungerende, menneskehjernen. Tidligere var forskerne henvist til å trekke konklusjoner om funksjonell anatomisk spesifisitet ut fra enten undersøkelser av pasienter med anatomisk begrensede skader, som er den klassiske nevropsykologiske tilnærming, eller bruke dyremodeller, som er den klassiske nevrofysiologiske tilnærming. fMRI gir ikke bare mulighet til å trekke konklusjoner om anatomisk lokalisering til enkelte regionale områder enten kortikalt eller subkortikalt, men også mulighet til å analysere hvordan ulike områder kommuniserer i kortikale nettverk, såkalt neuronal connectivity analysis (Friston et al., 1997). fMRI er basert på de samme fysiske prinsipper som strukturell MR, noe som er den vanlige bruken av MR-teknikken ved landets sykehus og røntgensentre, dvs. registrering av protonmagnetisk relaksasjonstid i grå hjernesubstans med bevaring av anatomisk spesifisitet. fMRI baserer seg spesifikt på forskjell i magnetisk egenskap ved oksygenert versus deoksygenert blod, der oksygenert blod har diamagnetiske egenskaper. Gjennom å sammenligne MR-bilder under baselinebetingelse og under kognitiv utfordring vil de områdene i hjernen der nevronene endret krav til metabolisme, gi et sterkere MR-signal enn under baseline grunnet forskjell i magnetiske egenskaper i en oksygenert versus deoksygenert tilstand (Buxton et al., 1998). Den respons, eller kontrast, som måles ved fMRI, kalles logisk nok Blood Oxygenation Level Dependent (BOLD) respons eller kontrast, noe som kommer av det faktum at fMRI reflekterer endring i lokal eller regional oksygenekstraksjon av nevronene.
Figur 1 viser hvordan en fMRI-undersøkelse går til like før pasienten eller forsøkspersonen legges inn i magnettrommelen.
Figur 1. 3.0 Tesla MR-skanner ved Haukeland Universitetssykehus. Forsøkspersonen kjøres inn i trommelen cirka 1,0 - 1,2 meter. Foto: Paul-Erik Lillholm, Universitetet i Bergen.
En fMRI-undersøkelse krever vanligvis presentasjon av sensorisk stimulus for å «drive» nevronene i de aktuelle områder og nettverk. Derfor brukes ofte spesielle «briller» som består av små LCD-dataskjermer som monteres utenpå den spolen som omkranser forsøkspersonens hode. På tilsvarende måte brukes spesielle ikke-magnetiske MR-kompatible hodetelefoner for presentasjon av lydstimuli (se figur 1). Stimuli presenteres i blokker på 30 - 60 sekunder som alternerende gjentas med baseline som kan enten være hvile eller et annet sensorisk stimulus. En slik design blir kalt en ON-OFF eller blokk-design, der ON, respektive OFF, representerer aktivt stimulus versus baseline-stimulus. En annen type eksperimentell design, som kalles «event-related», tillater at aktiveringsbilder kan analyseres til ulike typer stimuli i en stimulus-blokk. I en event-related design presenteres enkelte stimuli med varierende tidsavstand mellom disse. Når en analyserer fMRI-dataene, så kan en i en event-related design måle det gjennomsnittlige BOLD-signalet til ett enkelt stimulus, mens en blokkdesign viser gjennomsnittet over hele tidsperioden for en stimulus-blokk, vanligvis 30 - 60 sekunder. En event-related design stiller imidlertid også større krav til gjennomføring og analyse av en fMRI-undersøkelse og er ikke å anbefale som første design.
fMRI gir mulighet til avbildning av regional nevronal spesifisitet med hensyn til kognitive funksjoner i en intakt menneskehjerne, og gir mulighet til å lage såkalte «cognitive maps» over lokalisering av gitte funksjoner som hukommelse, oppmerksomhet, språkfunksjoner etc. Det sier seg selv at en slik tilnærming vil kunne ha store kliniske implikasjoner, da forskeren kan teste spesifikke hypoteser om hvilke områder i hjernen som er dysfunksjonelle ved ulike mentale tilstander, kanskje spesielt ved psykiske og nevrologiske lidelser, som schizofreni, depresjon, epilepsi, Parkinsons sykdom, for å nevne noen eksempler, men også ved andre tilstander som dysleksi og andre språkrelaterte problemer, samt f.eks. ADHD. fMRI har også vist seg som et viktig komplement til kliniske og andre metoder ved lokalisering av sensoriske, motoriske og kognitive områder ved tumor-kirurgi, der spørsmålet for nevrokirurgen er om tumor har infiltrert en spesifikk funksjon eller kun dislokalisert funskjonen i nærheten av tumor. Tilsvarende benyttes fMRI som et tillegg til andre teknikker for å bestemme lokaliseringen av kognitiv funksjon (f.eks. språk og hukommelse) før eventuell reseksjonskirurgi hos pasienter med epilepsi. På denne måten kan det vurderes før operasjon hvordan et eventuelt kirurgisk inngrep eventuelt vil påvirke kognitiv funksjon etter inngrepet.
Historikk
fMRI ble introdusert i Norge i 1993 da professor Kenneth Hugdahl og kolleger ved Universitetet i Bergen og Haukeland Universitetssykehus gjennomførte de første fMRI-undersøkelser basert på BOLD-kontrast (se Lundervold et al., 1995, som er den første publikasjon med fMRI publisert av norske forskere), drøye tre år etter at de aller første studiene på fMRI ble publisert av amerikanske forskere (Belleviau et al., 1991). De første studier som brukte fMRI-metoden i psykiatrisk sammenheng for undersøkelse av pasienter med psykiske lidelser, var Renshaw et al. (1994) og Wenz et al. (1994), se også Hugdahl og Specht (2005) for en oversikt over norsk fMRI-forskning på psykiske lidelser. Kenneth Hugdahl og kolleger startet fMRI-Gruppen i Bergen i 1994, som i 2003 fikk status som «Nasjonalt Kompetansesenter i fMRI» sammen med forskere fra St. Olavs Hospital i Trondheim. I de siste årene har fMRI-undersøkelser også blitt gjennomført ved Universitetet i Oslo ved Rikshospitalet, ved Ullevål Universitetssykehus, samt ved NTNU og Universitetet i Tromsø. fMRI-undersøkelser vil helt sikkert bli mer vanlig også ved andre norske sykehus og universiteter etter som MR-teknologien blir stadig mer tilgjengelig også i Norge.
Den første norske fMRI-undersøkelsen benyttet en vanlig stroboskoplampe for å generere korte lysimpulser som ble presentert for forsøkspersonen i 30 sekunders intervaller alternerende med like lange mørke intervaller. Tanken var å «drive» nevronene spesifikt i oksipitallappen (synscortex) med hypotesen at nevroner som er sensitive for visuell prosessering, vil kreve mer oksygen ved stroboskoplys-stimulering enn nevroner som ikke er sensitive for visuell prosessering. Resultatene viste signifikant aktivering i primære synscortex (areae 17 - 19) i oksiptallappen, også når analyse ble gjort av enkeltindivider, dvs. at effekten ikke var avhengig av statistisk midling av gruppedata.
Den klassiske Stroop-effekten og frontale hjerneområder
Figur 1 viser et typisk fMRI-aktiveringsbilde som er en sammenligning mellom nevronal aktivering i frontale områder av hjernen hos friske forsøkspersoner når de løser en oppgave med Stroop-inkongruente fargeord. Figur 2a viser aktivering når forsøkspersonene skal huske og gjengi det ordet som vises på en dataskjerm som forsøkspersonen har foran øynene. Figur 2b viser aktivering når forsøkspersonene skal huske og gjengi den fargen ordet er skrevet i. Legg merke til den markante forskjellen i aktivering i fremre frontale områder av hjernen når forsøkspersonene skal huske og gjengi fargen ordet er skrevet i, dvs. når de skal løse den typiske Stroop-konflikten. Figur 2 er et godt eksempel på sensitiviteten hos fMRI. Den eneste prosedyreforskjellen mellom figur 2a og figur 2b er at forsøkspersonene ble gitt forskjellige instrukser om hvilken aspekt av stimulus de skulle fokusere på. Ellers var situasjonen identisk på figurene 2a og 2b. Å fokusere på den fargen ordet er skrevet i, krever sannsynligvis bruk av eksekutive kognitive funksjoner, der forsøkspersonen må inhibere den «automatiske» tendensen til å fokusere på ordet i seg selv. Eksekutive funksjoner engasjerer frontale områder i hjernen i større grad enn rene oppmerksomhetsoppgaver, noe som også klart fremgår av figur 2b.
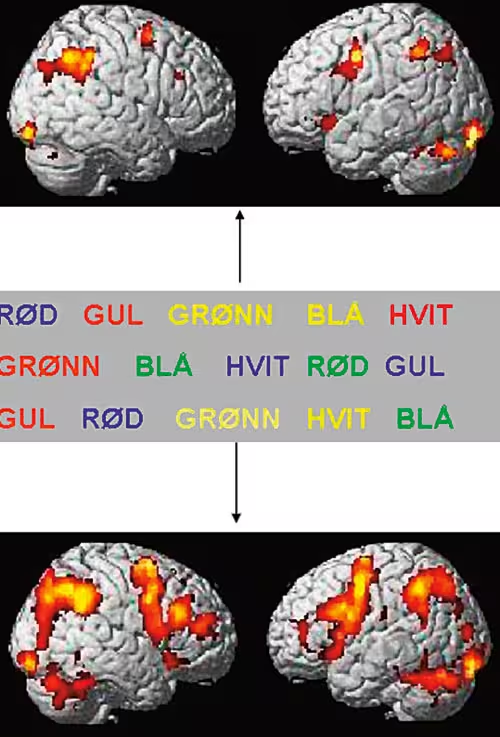
Figur 2 BOLD fMRI aktiveringsbilde når forsøkspersoner løser den kjente Stroop-testen, her brukt som arbeidsminnetest. Det øvre bildet viser aktivering når forsøkspersonene skal huske og gjengi hvert fargeord. Det undre bildet viser aktivering når de samme forsøkspersonene skal huske å gjengi fargen som ordet er skrevet i. Legg merke til den markerte økningen i aktivering i fremre deler av hjernen når forsøkspersonene skal konsentrere seg om fargen ordet er skrevet i. Data fra masteroppgave av Ole Gunnar Viken, Masterprogrammet i neuroscience, NTNU/fMRI-Gruppen i Bergen.
At fMRI er en sensitiv metode for å oppdage små endringer i nevronal aktivering mellom ulike kognitive oppgaver, er også i en viss forstand en begrensning ved metoden i den betydning at fMRI savner spesifisitet. Prefrontal aktivering skjer ved en rekke ulike oppgaver som alle lader på komplekse kognitive funksjoner, for eksempel oppmerksomhet, arbeidshukommelse, reguleringsfunksjoner og språkfunksjoner.
fMRI må baseres på hypoteser om nevrokognitive sammenhenger
Det er viktig å huske at alle funksjonelle avbildningsteknikker, også fMRI, er basert på en hypotese om sammenheng mellom kognitiv funksjon og tilsvarende lokalisering av hjerneaktivering. En må derfor alltid huske å spørre hvilken eller hvilke kognitive prosesser eller funksjoner som forventes reflektert i fMRI-resultatene. fMRI er derfor særdeles godt egnet til å vurdere kliniske tilstander der nettopp kognitiv svikt er fremtredende kjennetegn ved tilstanden. Schizofreni er nettopp karakterisert ved alvorlig svikt i flere sentrale kognitive funksjoner, som arbeidshukommelse, først påvist av Weinberger og Cermak (1973), se også Green (1996); Egan et al. (2001); Hugdahl et al. (2004), og episodisk hukommelse (Gold et al., 1992). En interessant observasjon ble gjort av Egeland et al. (2003), som sammenlignet en gruppe schizofrene pasienter med en gruppe deprimerte pasienter. Mens de deprimerte pasientene hadde problemer med fremkalling (retrieval) av innlært materiale, strevet de schizofrene pasientene med innlæringen (encoding) av det samme materialet. Avklaringen av slike forskjeller i spesifikke kognitive funksjoner og subprosesser kan være et viktig skritt i retning av kognitiv diagnostisering. Et annet område der schizofrene pasienter viser svikt, er i såkalte eksekutive funksjoner, som planlegging og responsinhibisjon. Flere sentrale fMRI- studier har påvist en sammenheng mellom redusert nevronal aktivering i de prefrontale delene av cortex og svekket evne til eksekutiv funksjon (Curtis et al., 1999; Quintana et al., 2003; Hugdahl et al., 2004).
Validering mot atferdsdata
På samme måte som ved andre funksjonelle avbildningsteknikker må fMRI-data valideres mot atferdsdata. Det betyr at pasientens eller forsøkspersonens resultat på de kognitive oppgavene som brukes i en fMRI-undersøkelse, er en viktig kilde til hvordan fMRI skal tolkes. Atferdsdata innebærer oftest mål på hvor godt pasienten klarer oppgaven (antall riktige skårer, prosentskåre etc.), eller tid fra stimulus blir presentert, til respons blir avgitt (reaksjonstid, RT). Analyse av atferdsdata blir særdeles viktig ved kliniske fMRI- undersøkelser der pasienter sammenlignes med friske kontrollpersoner. Problemet med å sammenligne fMRI-resultater mellom kliniske grupper og kontrollgrupper i fravær av atferdsdata oppstår spesielt når pasientgruppen mangler aktivering i en gitt region sammenlignet med kontrollgruppen. I fravær av atferdsdata kan vi ikke utelukke at pasientene har gitt opp oppgaven, og at fravær av aktivering kommer av at de ikke prøvde seg på oppgaven, eller at oppgaven var altfor vanskelig og de derfor ikke klarte å holde motivasjonen oppe. Et klassisk eksempel på mulige feilslutninger var tidlige fMRI-studier av verbal fluency, der schizofrene og friske kontrollpersoner ble sammenlignet. Ettersom verbale responser er vanskelige i en fMRI-undersøkelse, fordi bevegelse av luft i luftrøret skaper artefakter i MR-bildene, ble forsøkspersonene bedt om å utføre oppgaven «inne i hodet» uten å si noe. Manglende prefrontal aktivering hos de schizofrene pasientene kan i en slik situasjon ikke utelukkes å være en konsekvens av at personen ikke har utført oppgaven av andre grunner enn at han/hun har en spesifikk svikt i denne type kognisjon.
Spatial versus temporal oppløsning
Både fMRI og PET har begrensninger med hensyn på tidsmessig oppløsning i det signalet man registrerer. Til forskjell fra elektrofysiologiske metoder som opererer i millisekund-området, opererer de hæmodynamiske teknikkene i sekundområdet. Det betyr at mentale prosesser ikke kan studeres on-line, dvs. samtidig med at de skjer, men som gjennomsnittlige effekter over lengre tid, oftest 1/2 til 1 minutt. En annen begrensning er at metodene ikke diskriminerer mellom øket lokal nevronal aktivering, som har en reduserende eller inhiberende effekt på nervesystemet. Det nevrofysiologiske grunnlaget for den såkalte BOLD- effekten i fMRI er også lite kjent; mye er fremdeles ukjent om hvordan endring på synapsenivå gjenspeiler seg i endret hæmodynamisk respons. Slike forhold er ikke minst viktige ved for eksempel fMRI-undersøkelser av psykiatriske pasienter under medisinering. Se Moonen og Bandettini (1999) for en oversikt over begrensninger ved fMRI-metoden. I denne sammenhengen er det interessant å notere seg at psykiatrien er det medisinske fagområde som i størst utstrekning har tatt i bruk de nye funksjonelle hjerneavbildningsteknikkene både i forskning og klinisk bruk. Det er vårt håp at klinisk nevropsykologi tar opp den utfordringen psykiatrien har gitt dem, og at de nye avbildningsteknikkene også blir benyttet i klinisk psykologi.
Statistisk analyse av fMRI-data
En typisk fMRI-undersøkelse stiller store krav til databearbeiding og statistiske analyser. Det er tilgjengelig forskjellige kommersielle programmer og freeware-programmer som er utviklet for analyse av fMRI-data (SPM2, AFNI, FST, BrainVoyager mfl.). Felles for samtlige programpakker er at de har en pre- og postprosesseringsprosedyre der data først pre-prosesseres for å korrigere for f.eks. bevegelsesartefakter. Det er uunngåelig at forsøkspersonene beveger hodet under et fMRI-opptak. Derfor har alle analyseprogrammer spesielle algoritmer som retter disse bevegelsene. For å kunne sammenligne resultatene mellom f.eks. en pasientgruppe og en kontrollgruppe må samtlige bilder transformeres til en felles anatomisk hjerne, en såkalt referansehjerne. En slik referansehjerne er f.eks. MNI-referansen som er utgitt av Montreal Neurological Institute, og som er basert på 152 anatomiske referanser. Statistisk analyse av preprossesserte fMRI-data baseres enten på inferens- eller korrelasjonsstatistikk. Mest hyppig brukt er inferensstatistiske modeller som f.eks. den generell-lineære modellen (GLM). GLM prøver mot nullhypotesen at det er null samvariasjon mellom fMRI-signalet og stimuluspresentasjon. Det skjer på grunnlag av lineært vektede kontraster, dvs. sammenligning av stimuluspresentasjon mot baseline. For en slik kontrast gjennomføres enten t- eller F-test for hvert voksel i hele hjernevolumet. Det betyr at opp mot 10 000 antatt uavhengige t- eller F-tester gjennomføres. For å redusere risiko for «massesignifikans» brukes ulike statistiske korreksjonsprosedyrer basert på Gaussian-Random-Field-teori. De endelige fMRI-resultatene blir visualisert som statistiske parametriske kart (SPMs), som fargede områder på et 3D anatomibilde av hjernen som vist i figur 2.
fMRI og kognitiv svikt ved schizofreni
En fremtredende hypotese ved funksjonell hjerneavbildning ved schizofreni er at schizofrene pasienter har redusert blodgjennomstrømming i de fremre, frontale, delene av hjernen. Denne såkalte hypofrontaliteten når pasientene var i hvile, ble først påvist av Ingvar og Franzen (1974) og var særdeles fremtredende hos eldre pasienter med et langvarig sykdomsforløp. I senere år har flere forskere vist at baseline-hypofrontalitet sannsynligvis er avhengig av den undergruppen av pasienter som blir undersøkt og den spesifikke kognitive provokasjonen som blir brukt (se Berman & Weinberger, 1991 for oversikt). Noen arbeider har dessuten påvist at hypofrontalitet kan være et fremtredende trekk hos umedisinerte pasienter, som kan bedres etter medikamentell behandling, spesielt ved behandling med nye antipsykotiske psykofarmaka som f.eks. Olanzapin eller Risperidone (jf. Honey et al., 1999). Begrepet «hvile» blir her brukt i en spesiell betydning, som fravær av stimuluspresentasjon/instrukser. I psykologisk forstand betyr selvsagt ikke «hvile» fravær av subjektiv kognitiv aktivitet, men altså fravær av spesifikke oppgaver eller stimuluspresentasjon. De til dels motstridende resultatene som er fremkommet ved undersøkelse av hjernefunksjon i hvile, kan eventuelt forklares ved at undersøkelser av endring i blodgjennomstrømming i hjernen i en hviletilstand ikke er tilstrekkelig for å fange opp en eventuell hypofrontalitet. Til det kreves sannsynligvis en form for kognitiv provokasjon som involverer frontale hjernestrukturer.
Ifølge Green (1996; se også Rund, 1998) er hukommelsesproblemer særdeles fremtredende ved schizofreni. Andre kognitive funksjoner som også ofte er svekket ved schizofreni, involverer eksekutive funksjoner, slik som overordnede funksjoner som mental fleksibilitet, inhibisjon og problemløsning. Eksekutive funksjoner aktiverer områder i frontallappene, spesielt i dorsolaterale prefrontale cortex. En variant av korttidshukommelse er arbeidshukommelse (working memory), som utgjør den delen av hukommelsen et individ holder «aktiv» til enhver tid. Arbeidshukommelsen kan ses på som et kognitivt system for å holde en begrenset mengde informasjon tilgjengelig over en begrenset tid for å løse en spesifikk oppgave. Etter at informasjonen er brukt, blir den ekskludert fra systemet, og ny informasjon blir tatt inn, etc. Det betyr at arbeidshukommelsen har komponenter av både gjenkalling av informasjon og aktiv inhibisjon eller undertrykking av informasjonen etter at oppgaven er løst. Arbeidshukommelse forklares ofte ut fra Baddeley og Hitch (1974) sin modell over hvordan denne type hukommelse opererer.
Interessant nok har ikke all hjerneavbildningsforskning på hukommelse og schizofreni gitt de samme resultatene. Heckers et al. (1998) fant at områder i prefrontale cortex ble omtrent likt aktivert hos pasienter med schizofreni og friske kontrollpersoner. En mulig årsak til at ulike studier har fått ulike resultater, kan være at de hukommelsesoppgavene som blir benyttet, medfører ulik grad av kognitiv belastning (jf. Carter et al., 1998). En annen faktor som kan ha spilt inn, er at ikke alle studier har kontrollert for nivå av arousal og vigilans i oppgavene. Det betyr at avbildningsstudier ved arbeidshukommelse bør ha minst to betingelser, én som inneholder høy grad av vigilans, men ikke krav på arbeidshukommelse, og én som har begge komponentene.
Figur 3 viser klart redusert aktivering i schizofrenigruppen sammenlignet med den friske kontrollgruppen når oppgaven var å legge sammen to og to tall. Forskjellene mellom gruppene var mest markant for de prefrontale områdene. Schizofreni-gruppen aktiverte imidlertid parietale områder, spesielt i inferiør parietal cortex (Brodmann area 39/40), noe som kan tyde på kompensatorisk aktivering. Atferdsdata viste rundt 75 % korrekte responser i schizofrenigruppen, sammenlignet med 95 % i den friske kontrollgruppen, slik at forskjellene i aktivering ikke kan forklares ut fra at schizofrenigruppen ikke klarte å løse oppgavene. Dette utdypes nedenfor.
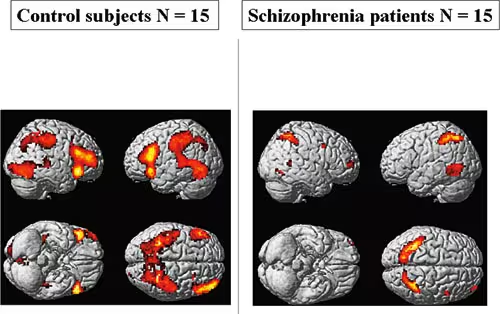
Figur 3 BOLD fMRI aktiveringsdata fra friske kontrollpersoner og pasienter med schizofreni under løsning av en arbeidsminnestest (huske rekkefølgen på konsekutivt presenterte tall). Legg merke til den typiske «hypofrontaliteten» hos de schizofrene pasientene, dvs. markert reduksjon i aktivering i de fremre frontale delene av hjernen. Data fra Hugdahl et al., American Journal of Psychiatry, 2004.
Kompensatorisk aktivering
Nyere forskning på arbeidshukommelse har argumentert for en fraksjonering av de prosessene som inngår i denne type hukommelse (Owen et al., 2000), spesielt angående lokalisering av aktivering i prefrontale cortex. Owen og medarbeidere argumenterer for at områder i ventrolaterale cortex prinsipielt styrer organisering av respons-sekvenser som er basert på bevisst eksplisitt fremkalling av informasjon. De midterste områdene av frontal cortex er ansvarlige for organisering av eksekutive funksjoner som har å gjøre med aktiv manipulering og monitoring av informasjon som allerede finnes i arbeidshukommelsen. Den spesifikke oppgaven med å legge sammen to og to tall, som beskrives i avsnittet ovenfor, se også figur 3, kan sies å lade på begge disse komponentene, da forsøkspersonene foruten å aktivt fremkalle informasjon ved hvert tall også var nødt til å manipulere informasjonen for å komme frem til summen. Det synes åpenbart at pasienter med schizofreni hadde problemer med de komponentene som går på aktiv fremkalling av informasjon, der de stort sett manglet aktivering i de mer ventrale frontale områdene, med unntak av et lite område i høyre hemisfære. Den parietale aktiveringen kan imidlertid tyde på at pasientene med schizofreni klarte å manipulere den informasjonen som ble gitt, men at de ikke klarte å huske hvilke tall som ble presentert, i samme grad som kontrollpersonene. Pasientgruppen synes faktisk å «kompensere» manglende frontal aktivering med overaktivering av parietale deler, noe som kan skyldes det spesielle med den oppgaven som ble gitt, fordi oppgaven også krever evne til tallmanipulasjon og mental aritmetikk. Denne tolkningen får til dels støtte fra undersøkelsen av Calicott et al. (1998), som også brukte en oppgave på arbeidshukommelse. Hovedfunnene var redusert aktivering i dorsolaterale prefrontal cortex og en tendens til overaktivering i parietal cortex. Det er interessant å merke seg at pasienter med alvorlig depresjon også viser redusert prefrontal aktivering til de samme oppgavene, noe som peker mot at redusert prefrontal aktivering ikke er et unikt trekk ved schizofreni. Her har kanskje fMRI sin største utfordring, balanseringen mellom sensitivitet og spesifisitet ved BOLD-undersøkelser.
Tolkning av nevrokognitiv svikt hos pasienter med schizofreni er dessverre ofte utelukkende basert på «test performance». Påstander om sammenhenger mellom kognitiv prestasjon og hjernefunksjon er ofte basert på «reason-by-analogy». Det kan illustreres med følgende: Om pasienter med schizofreni ikke klarer en nevropsykologisk test som også pasienter med en skade i frontallappene har problemer med, så trekker vi ofte den slutningen at pasienter med schizofreni karakteriseres av prefrontal dysfunksjon. Det kan imidlertid være flere andre grunner til at pasienter med schizofreni ikke klarer testen. En annen refleksjon er at ofte blir hele spektret av symptomer korrelert med en hel rekke nevropsykologiske tester, på en nærmest ad hoc basis, uten en klar teoretisk forståelse av hvilke symptomer som bør korrelere med hvilke kognitive funksjoner. Dette har ført til at en i det siste har begynt å se på korrelasjoner mellom symptomprofil og nevronal aktivering i fMRI-undersøkelser. Her kan en skille mellom to eksperimentelle tilnærminger. En tilnærming ser på samsvar mellom nevronal aktivering og fluktuering i symptomer mens pasienten ligger i MR-skanneren. Den andre tilnærmingen ser på nevronal aktivering til kognitive stimuli hos pasienter som ut fra symptomprofil forventes å fremvise svikt til nettopp slike stimuli. Flere studier har sett på nevronal aktivering ved positive symptomer, spesielt auditive hallusinasjoner. Et eksempel på den første tilnærmingen står Shergill og medarbeidere (2000) for. Disse forskerne benyttet en ny teknikk der fMRI-bildene ble registrert i irregulære intervaller (såkalte ON-blokker), og spurte pasientene direkte etter hver opptakssekvens om de hallusinerte under opptaket. Resultatene viste en signifikant kontrasteffekt mellom hallusinerende og ikke-hallusinerende fMRI-sekvenser, med økt aktivering i frontale og temporale områder under hallusinasjon. Konklusjonen fra studien til Shergill et al. (2000) er at flere frontale og temporale områder er involvert i auditive hallusinasjoner, og at nevronene i de aktuelle områdene spontant fyrer under en hallusinatorisk episode. Et eksempel på den andre tilnærmingen er en studie av Woodruff et al. (1997) som presenterte talelyder via hodetelefoner til pasienter med hyppige hallusinasjoner, mens de lå i MR-skanneren. Hypotesen var at pasientene, sammenlignet med en frisk kontrollgruppe, ville vise redusert nevronal aktivering i språkområdene i bakre øvre venstre temporallapp, ut fra at nevronene i dette området allerede ville være «opptatt» med å prosessere den internt genererte opplevelsen «å høre stemmer». Eksternt presenterte språklyder ville derfor bli «blokkert» av stemmene, med redusert aktivering. Resultatene stemte overens med hypotesen med signifikant reduksjon i aktivering i venstre bakre øvre temporallapp i det samme området som resulterer i såkalt impressiv, eller Wernickes, afasi, ved hjerneskade.
fMRI for undersøkelse av språkfunksjon og hemisfærisk asymmetri
fMRI-gruppen i Bergen har i en årrekke brukt fMRI for undersøkelser av funksjonelle forskjeller i språkpersepsjon mellom høyre og venstre hemisfære. Disse undersøkelsene er blitt gjennomført med såkalt dikotisk lytting der forsøkspersonene eller pasientene får enkle stavelselyder som /ba/, /pa/ etc. presentert via hodetelefoner samtidig som de ligger inne i MR-skanneren. Stavelsene presenteres alltid dikotisk, dvs. to forskjellige stavelser presenteres samtidig ved hver presentasjon, en i hvert øre. Dikotisk lytting til enkle stavelser genererer oftest et såkalt right ear advantage (REA), som betyr at forsøkspersoner rapporterer flere korrekte gjengivelser for den stavelsen som blir presentert i høyre øre. REA reflekterer dominans for språkpersepsjon i den venstre hemisfæren og mer presist i den venstre øvre bakre region av venstre temporallapp (Hugdahl, 2003). En rekke undersøkelser har også vist at flere kliniske grupper mangler REA, som barn med dysleksi (Helland et al., 2008; Cohen et al., 1992) og interessant nok schizofrene pasienter som opplever hyppige hørselshallusinasjoner (Green et al., 1994; Hugdahl et al., in press). fMRI har konsekvent vist sterkere aktivering i venstre hemisfære ved dikotisk lytting (Pollmann et al., 2004; Jäncke et al., 2003; Thomsen et al., 2004), som også er replisert med PET-teknikken (Hugdahl et al., 1999). Figur 4 viser typisk asymmetri for nevronal aktivering i øvre temporallapp når friske forsøkspersoner lytter til dikotisk presentasjon av konsonant-vokal-stavelser samt reduksjon i de samme områdene hos pasienter ved schizofreni. Data er fra et samarbeidsprosjekt mellom fMRI-gruppen ved UIB og Hugo Jørgensen og Else-Marie Løberg ved Haukeland psykiatriske sykehus, der friske forsøkspersoner er sammenlignet med schizofrene pasienter.
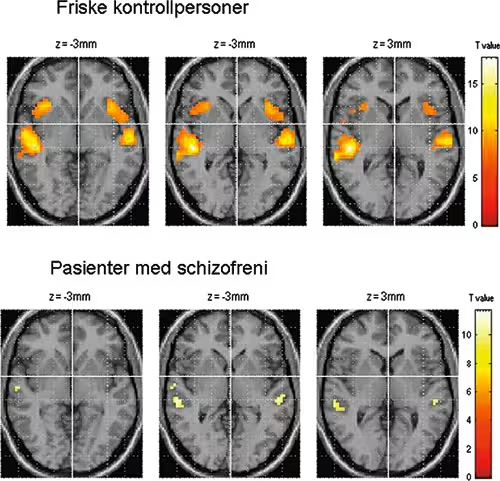
Figur 4 Preliminæ-re BOLD fMRI aktiveringsdata fra en gruppe pasienter med schizofreni og en frisk kontrollgruppe der begge gruppene gjennomgår en dikotisk lytting-test med konsonant-vokal-stavelser. Merk reduksjon i temporal aktivering hos pasientene sammenlignet med de friske kontrollpersonene. I samarbeid med Hugo Jørgensen og Else-Marie Lø-berg, Haukeland Psykiatriske Universitetssykehus, Sandviken.
Både visuelle hallusinasjoner og hørselshallusinasjoner rapporteres også hos en del epilepsi-pasienter i intervjuer ved Spesialsykehuset for Epilepsi (SSE). Et samarbeidsprosjekt mellom SSE ved Maria Korsnes og Hugdahls gruppe ved UiB undersøker nå om hørselshallusinasjoner hos epilepsipasienter har tilsvarende nevronalt opphav i den venstre bakre øvre temporallapp (STG, PT) som er funnet hos schizofrenipasienter. Om så er tilfellet, vil de nevronale prosessene som skaper auditive hallusinasjoner, være uavhengige av den psykiatriske diagnosen, fordi de altså kan opptre hos flere diagnostiske grupper som ellers ikke har felles etiologi. Et slikt utfall vil da bety identifisering av anormalitet spesifikt knyttet til et symptom uavhengig av diagnostisk kategori, noe som vil være et gjennombrudd i forskning på psykiske lidelser. Epilepsipasientene som har hørselshallusinasjoner, testes derfor med dikotisk lytting for konsonant-vokal-stavelser i MR-skanneren med fMRI-BOLD-sekvens, på samme måte som beskrevet tidligere for schizofrene pasienter. Siden gruppen epilepsipasienter er lite autogen med hensyn på lokalisering, og siden noen har gått igjennom kirurgisk behandling for sin epilepsi, vil det være interessant å undersøke hvordan eventuelle fellestrekk påvirker den venstre bakre øvre temporallapp.
I en serie av longitudinelle fMRI-studier i Bergen ble 6-årige barn undersøkt. Barna i studien er i en risikosone for å utvikle dysleksi, men en formell dysleksidiagnose kan ennå ikke gjøres. fMRI-undersøkelsen ble gjentatt to år senere ved 8 års alder, og en tredje undersøkelse planlegges i 2009. Dette er en del av «Ut med språket»-prosjektet som ledes av Turid Helland med Sonja Ofte og Karsten Specht som samarbeidspartnere, og det har så langt vist at barn med risiko for å utvikle dysleksi har signifikant lavere grad av nevronal aktivering i frontale og parietale områder i hjernen enn aldersmatchede barn som ikke er i risikosonen. En interessant iakttakelse er også at forskjellene var mindre mellom gruppene ved 8-årsalderen etter at begge grupper hadde hatt 2 år med formell lese- og skrivetrening i skolen.
Et annet prosjekt som ledes av Maria Korsnes, ved Epilepsisenteret Rikshospitalet (SSE-RH) ser på bruk av fMRI som et verktøy i preoperativ utredning av bl.a. lokalisering av kognitive funksjoner hos pasienter med epilepsi som utredes for kirurgisk behandling. Hvis epileptiske anfall ikke lar seg behandle medikamentelt, kan kirurgi vurderes. Den kirurgiske behandlingen involverer oftest reseksjon av det hjernevev der anfallene starter. Omtrent 60 - 70 prosent av pasienter som gjennomgår kirurgi, blir fullstendig anfallsfrie etter operasjon. Prognosen er best ved temporallappsepilepsi og påvisbar strukturell lesjon. Før eventuell reseksjon kartlegges mulige kognitive konsekvenser. Ved kirurgiutredning benyttes i dag en teknikk der deler av hjernen bedøves for å undersøke kognitive funksjoner i de «våkne» hjerneområdene (Wada-testing). I Norge foretas Wada-testen hovedsakelig på Rikshospitalet og ved de større sykehusene og krever innleggelse i to til tre døgn. Siden store områder bedøves samtidig, er det ikke mulig å predikere risiko for kognitiv svikt med stor nøyaktighet. fMRI er allerede en viktig metodikk som i dag benyttes i tillegg til allerede etablerte utredningsteknikker. Med mer erfaringsmateriale vil fMRI-resultatene tillegges mer vekt. Dersom det viser seg at man kan avstå fra Wada-testing for en del av pasientene, kan man spare pasienter for unødig risiko og unngå tidkrevende, ubehagelige prosedyrer. Man kan få en mer effektiv utredning, hvor det også er potensielle muligheter for økonomisk gevinst, idet Wada-test er kostnadskrevende og fører til økt antall liggedøgn på sykehus.
I det prosjektet som Maria S. Korsnes og kolleger gjennomfører, benyttes verbale og visuelle hukommelsesoppgaver som er designet slik at de skal fremkalle maksimal aktivering av henholdsvis språkområder og hukommelsesområder. Språkparadigmet, som har vært i bruk siden 200 4, viser gode resultater med hensyn til lateralisering av språkfunksjon. Et pågående forskningsprosjekt ved SSE-RH konsentrerer seg om hukommelsesfunksjoner, siden hukommelse har vært mindre fokusert på enn språkfunksjoner i tidligere forskning. Hippocampus og relaterte regioner i prefrontal cortex er primært assosiert med hukommelse for uforutsette hendelser, nye stimuli, eller familiære stimuli presentert i nye sammenhenger. Innlærte stimuli aktiverer hippocampus minimalt (Binder et al., 2005). Siden temporallappsepilepsi oftest oppstår i mesiale deler av temporallappen, spesielt hippocampus, er lateralisering av fMRI-aktivering i hippocampus i forbindelse med hukommelsesoppgaver spesielt interessant i denne utredningen. I slike pasientstudier holder det ikke å transformere hjernen til en normalisert templat. I fMRI-studien ved SSE-RH defineres anatomiske områder i polygoner for hver forsøksperson (ROI - regions of interest), og funksjonell aktivitet innenfor hvert anatomisk ROI kan da sammenliknes og eventuelt benyttes i gruppeanalyse (se figur 5).
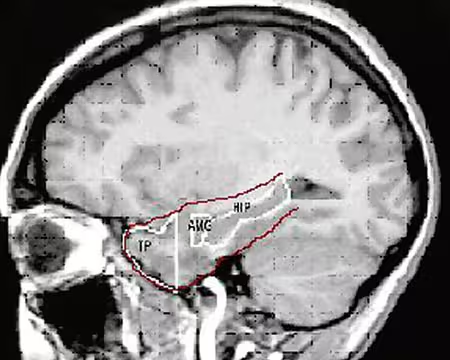
Figur 5 Identifisering av anatomisk region-of-interest (ROI) hos en pasient med temporallappepilepsi. Data fra Maria S. Korsnes.
Kan fMRI erstatte den kliniske diagnose?
Til tross for alle fMRI-studier (og PET-studier) er det i dag ikke mulig å bruke resultater fra en fMRI undersøkelse for å stille en diagnose, eller stole på aktiveringsmønstre ved evaluering av behandlingseffekter (Honey et al., 2004). Ingen spesifikk funksjonell svikt er for eksempel blitt påvist som unik for schizofreni, eller å karakterisere alle pasienter med schizofreni. fMRI kan derfor sies å ha høy grad av sensitivitet, men lav grad av spesifisitet når det kommer til kliniske studier. Dette trenger imidlertid ikke å være en begrensning i metoden, men kan reflektere at schizofreni er en heterogen lidelse. Problemet kan illustreres med hva vi vil kalle «det inverse inferensproblem». Det vanligste forholdet når vi ser på aktiveringsbilder, er at vi kjenner den kognitive manipulasjonen på forhånd, dvs. vi vet hvilke kognitive funksjoner og prosesser som er aktivert i en fMRI-studie, for så å se på hvilke områder i hjernen som korresponderer med de samme kognitive funksjonene. La oss imidlertid tenke oss det omvendte forholdet, at vi kun kjenner hvilke områder som er aktivert, for så å slutte oss til hvilken eller hvilke kognitive prosesser som er provosert. I dette tilfellet finnes det ingen unik løsning, da ingen unik kognitiv prosess er påvist å gi opphav til et unikt aktiveringsmønster som ikke også deles av andre prosesser. Eksempelvis er aktivering i prefrontale cortex sett på som en markør for arbeidshukommelse, og et flertall av fMRI-studiene har vist manglende aktivering i dette området ved schizofreni, såkalt «hypofrontalitet». Problemet er imidlertid at det samme området også blir aktivert ved språklige og oppmerksomhetskrevende oppgaver, slik som ved eksekutive funksjoner. På tilsvarende måte viser også pasienter med alvorlig depresjon redusert aktivering i prefrontale cortex, om enn i mindre grad enn pasienter med schizofreni (Hugdahl et al., 2004).
I en annen studie (Lund et al., 2002) ble en mor og en sønn som begge viste schizofrene trekk, undersøkt i det samme fMRI-paradigmet som ble benyttet av Hugdahl et al. (2004) før og etter seks måneders behandling med Olanzapin. Sønnen var en 23 år gammel gutt med en debuterende schizofreni. Moren hadde vært syk i over 20 år, men hadde vært uten medisinering de siste fire månedene. Hun var imidlertid i tiden før fMRI-undersøkelsen i en residiverende psykotisk fase, og det ble anbefalt at hun gjenopptok medisineringen. fMRI viste en klar hypofrontalitet hos både mor og sønn. Etter seks måneder på Olanzapin viste begge en klar tendens til normalisering av aktivering i de fremre delene av pannelappene, noe som samsvarte med en klar klinisk bedring. Studien av Lund et al. (2002) viser hvordan fMRI kan benyttes ved evaluering av behandlingseffekter, der kliniske parametere kan valideres mot objektive mål på endring.
Veien videre
Det skjer en rask utvikling innenfor MR-metoder for undersøkelser av pasienter med psykiske lidelser. To nye metoder er diffusjonstensoravbildning (DTI) og MR-spektroskopi. DTI tillater visualisering av hvit hjernesubstans, dvs. utbredelse av nervefibrer i hjernen. Gruppen i Bergen har gjennomført DTI analyse av pasienter med callosal agenesi i samarbeid med Knut Hestad og Karin Erngrund ved NTNU. MR-spektroskopi tillater registrering av spektra av aminosyrer som glutamat, kolin, NAA og andre transmitterstoffer. Sammen med reseptorstudier med PET kan MR-spektroskopi bli et viktig supplement for forståelse av synapsefunksjon ved kliniske tilstander, også ved utvikling av nye legemidler. Et eksempel på såkalt farmakologisk MR-avbildning er fMRI-undersøkelser som er del av dokotorgradsarbeidet til Heidi Wageningen. Effekt av medikamentet memantin som inhiberer effekten av glutamat på reseptornivå, studeres i en fMRI-undersøkelse med dikotisk lytting. En annen applikasjon er morfometriske analyser av regionale anatomiske forhold mht. analyse av f.eks. grå hjernesubstans i fremre prefrontale og temporale områder ved ulike kliniske tilstander. Slike analyser kan gi viktige bidrag til spørsmålet om utviklingsmessige og degenerative forhold ved ulike kliniske tilstander.
Referanser
Baddeley, A. & Hitch, G.J. (1974). Working memory. In G.A. Bower (Ed.). The psychology of learning and motivation. New York: Academic Press.
Bellevieau, J. W., Kennedy, D. N., McKinstry, R. C. & et, al. (1991). Functional mapping of the human visual cortex by magnetic resonance imaging. Science, 254, 716 - 718.
Berman, K. F. & Weinberger, D. R. (1991). Functional localization in the brain schizophrenia. In A. Tasman & S. M. Goldfinger (Eds.). American Psychiatric Press Review of Psychiatry, Vol. 10. Washington, D.C: APP.
Binder JR, Bellgovan PSF, Hammeke TA, Possing ET & Frost JA. (2005). A comparison of two fMRI protocols for elicting hippocampal activation. Epilepsia, 46,1061 - 1070.
Buxton, R. B., Wong, E. C. & Frank, L. R. (1998). Dynamics of blood flow and oxygenation changes during brain activation: the balloon model. Magnetic Resonance in Medicine, 39, 855 - 864.
Callicott, J., Ramsey, N., Tallent, K. et al. (1998).fMRI brain mapping in psychiatry: Metodological issues illustrated in a study of working memory in schizophrenia. Neuropsychopharmacology, 18, 186 - 196.
Carter, C. S., Perlstein, W., Ganguli, R., Brar, J., et al. (1998). Functional hypofrontality and working memory dysfunction in schizophrenia. American Journal of Psychiatry, 155, 1285 - 1287.
Cherry, S. R. & Phelps, M. E. (2002). Imaging brain function with positron emission tomography. In A. W. Toga & J.C. Mazziotta (Eds). Brain imaging: The methods. New York: Academic Press.
Cohen, M., Hynd, G. W. & Hugdahl, K. (1992). Dichotic listening performance in subtypes of developmental dyslexia and a left temporal lobe brain tumor contrast group. Brain and Language, 42, 187 - 202.
Cohen, M. S. & Bookheimer, S. Y. (1994). Localization of brain function using magnetic resonance imaging. Trends in Neurosciences, 17, 268 - 277.
Curtis, V. A., Bullmore, E. T., Morris, R. G., Brammer, M., Williams, S.C., Simmons, A et al.. (1999). Attenuated frontal activation in schizophrenia may be task dependent. Schizophrenia Research, 37, 35 - 44.
Egan, M. F., Goldberg, T. E., Kolachana, B. S., Callicot, J. H., Mazzanti, C. M., Straub, R. E. et al. (2001). Effect of COMT Val108/158 MET genotype on frontal lobe function and risk for schizophrenia. Proceedings of the National Academy of Sciences, 98, 6917 - 6922.
Egeland, J., Sundet, K., Rund, B. R, Asbjørnsen, A., Hugdahl,K., Landrø, N. I., Roness, A. & Stordal, K. (2003). Sensitivity and specificity of memory dysfunction in schizophrenia: A comparison with major depression. Journal of Clinical and Experimental Neuropsychology, 25, 79 - 93.
Green, M. F., Hugdahl, K. & Mitchell, S. (1994). Dichotic listenig during auditory hallucinations in schizophrenia. American Journal of Psychiatry, 151, 357 - 362.
Green, M. F. (1996). What are the functional consequences of neurocognitive deficits in schizophrenia. American Journal of Psychiatry, 153, 321 - 330.
Friston K. J., Buechel C, Fink G. R., Morris J., Rolls E, Dolan R. J. (1997). Psychophysiological and modulatory interactions in neuroimaging. Neuroimage. 6, 218-229.
Heckers, S., Rauch, S. L., Goff, D., Savage, C. R., Schacter, D. L. et al. (1998). Impaired recruitment of the hippocampus during conscious recollection in schizophrenia. Nature Neuroscience, 1, 318 - 323.
Helland, T., Asbjørnsen, A., Hushovd, A. E. & Hugdahl, K. (2008). Dichotic listening and school performance in dyslexia. Dyslexia, 14, 42 - 53
Honey, G. D., Bullmore, E. T., Soni, W., Varatheesan, M., Williams, S. C. R. and Sharma, T. (1999). Difference in frontal cortical activation by a working memory task after substitution of risperidone for typical antipsychotic drugs in patients with schizophrenia. Proceedings of the National Academy of Sciences, USA, 96, 13432 - 13437.
Honey, G. D., McGuire, P. K. & Bullmore, E. T. (2004). Functional magnetic resonance imaging. In: S. Lawrie, E. Johnstone, and D. Lawrie (red.) Schizophrenia - From neuroimaging to neuroscience. New York: Oxford University Press.
Huettel, S. A, Song, A. W. & McCarthy, G. (2004). Functional magnetic resonance imaging. Sunderland, MA: Sinauer Associates.
Hugdahl, K., Rund, B. R., Lund, A., Asbjørnsen, A., Egeland, J., Landrø, N. I., Roness, A., Stordal, K., Sundet, K. & Thomsen, T. (2004). Brain Activation Measured With fMRI During a Mental Arithmetic Task in Schizophrenia and Major Depression. American Journal of Psychiatry, 161, 286 - 293.
Hugdahl, K. (2003). Dichotic listening in the study of auditory laterality. I: K.Hugdahl & R. J. Davidson (red.), s. 441 - 476. The asymmetrical brain. Cambridge, MA: MIT Press.
Hugdahl, K., Brønnick, K., Kyllingsbæk, S., Law, I., Gade, A. & Paulson, O.B. (1999). Brain activation during dichotic presentations of consonant-vowel and musical instruments stimuli: A 15O-PET study. Neuropsychologia, 37, 431 - 440.
Hugdahl, K,Løberg, E. M, Jørgensen, H. A,Lundervold, A, Lund, A, Green, M. F. & Rund, B. (2008). Left hemisphere lateralization of auditory hallucinations in schizophrenia: A dichotic listening study. Cognitive Neuropsychiatry, 13, 166 - 179
Hugdahl, K. & Specht, K. (2005). Funksjonell magnetresonansavbildning (fMRI) av hjernen ved psykotiske lidelser. In B. R. Rund (red.), s. 173 - 191. Schizofreni. Stavanger: Hertervig forlag,
Ingvar, D. & Franzen, G. (1974). Distribution of cerebral activity in chronic schizophrenia. Lancet, 2, 1484 - 1486.
Jäncke, L., Specht, K. Shah, J. N. & Hugdahl, K. (2003). Focused attention in a simple dichotic listening task: an fMRI experiment. Brain reserach, Cognitive Brain Reserach, 16, 257 - 266.
Lund, A., Thomsen, T., Kroken, R., Smievoll, A. I., Landrø, N. I., Barndon, R., Ersland, L., Iversen, J., Sundet, K., Lundervold, A., Asbjørnsen, A., Rund, B. R. & Hugdahl, K. (2002). «Normalization» of brain activation in schizophrenia. An fMRI study. Schizophrenia Research, 58, 333 - 335.
Lundervold, A., Ersland, L., Gjesdal, K. I., Smievoll, A. I., Tillung, T., Sundberg, H. & Hugdahl, K. (1995). Functional magnetic resonance imaging of primary visual processing using a 1.0 Tesla scanner. International Journal of Neuroscience, 81, 151 - 168.
Moonen, C. T. W. & Bandettini, P. A. (Eds.) (1999). Functional MRI. Berlin: Springer Verlag.
Owen, A. M., Lee, A. C. H. & William, E. J. (2000). Dissociating aspects of verbal working memory within the human frontal lobe: Further evidence for a «process-specific» model of lateral frontal organization. Psychobiology, 28, 146 - 155.
Quintana, J., Wong, T., Ortiz-Portillo, E., Kovalik, E., Davidson, T, Marder, S. R. et al. (2003). Prefrontal-posterior parietal network in schizophrenia: Primary dysfunction and secondary compensations. Biological Psychiatry, 53, 12 - 24.
Pollmann, S, Lepsien, J., Hugdahl, K. & von Cramon, DY. (2004). Auditory target detection in dichotic listening involves the orbitofrontal and hippocampal paralimbic belts. Cerebral Cortex, 14, 903 - 913
Renshaw, P. F., Yergelun-Todd, D. A. & Cohen, B. M. (1994). Greater hemodynamic response to photic stimulation in schizophrenic patients: An echo planar MRI study. American Journal of Psychiatry, 151, 1493 - 1495.
Rund, B. R. (1998). A review of longitudinal studies of cognitive functions in schizophrenia patients. Schizophrenia Bulletin, 24, 425 - 435.
Shergill, S. S., Brammer, M. J., Williams, S. C., Murray, R. M. & McGuire, P. K. (2000). Mapping auditory hallucinations in schizophrenia using functional magnetic resonance imaging. Archives of General Psychiatry, 57, 1033 - 1038
Thomsen, T., Rimol, L. M., Ersland, L. & Hugdahl, K. (2004). Dichotic listening reveals functional specificity in prefrontal cortex: an fMRI study. Neuroimage, 21, 211 - 218.
Weinberger, E. & Cermak, L. S. (1973). Short-term retention in acute and chronic paranoid schizophrenics. Journal of Abnormal Psychology, 82, 220 - 225.
Wenz, F., Schad, L. R., Knopp, M. V., Baudendistel, K. T., Flomer, F. & Schroder, J. et al. (1994). Functional magnetic resonance imaging at 1.5 T: Acyivation pattern in schizophrenic patients receiving neuroleptic medication. Magnetic Resonance Imaging, 12, 975 - 982.
Woodruff, P. W., Wright, I. C., Bullmore, E. T., Brammer, M., Howard, R. I, Williams, S. C. et al. (1997). Auditory hallucinations and the temporal cortical response to speech in schizophrenia: A functional magnetic imaging study. American Journal of Psychiatry, 154, 1676 - 1682.Vitenskap og psykologi
