Prosesseringstempo og oppmerksomhet ved schizofreni og depresjon
Jens Egeland, Bjørn Rishovd Rund, Kjetil Sundet, Nils Inge Landrø, Arve Asbjørnsen, Kenneth Hugdahl, Anders Lund, Atle Roness & Kirsten Stordal
-
Jens Egeland
Klinikk for Psykisk Helse og Rusbehandling, Sykehuset i Vestfold, Psykologisk institutt, Universitetet i Oslo
jens.egeland@siv.no
- Bjørn Rishovd Rund
-
Kjetil Sundet
Psykologisk institutt, Universitetet i Oslo
-
Nils Inge Landrø
Psykologisk institutt, Universitetet i Oslo,
n.i.landro@psykologi.uio.no
-
Arve Asbjørnsen
Institutt for samfunnspsykologi, Psykologisk Fakultet, Universitetet i Bergen
-
Kenneth Hugdahl
Inst. for biologisk og medisinsk psykologi, Psykologisk Fakultet, Univ. i Bergen
hugdahl@uib.no
-
Anders Lund
Psykiatrisk Institutt, Universitetet i Bergen
-
Atle Roness
Psykiatrisk Institutt, Universitetet i Bergen
-
Kirsten Stordal
Psykiatrisk Institutt, Universitetet i Bergen
Processing speed and attention in schizophrenia and depression
Attention measures attained from subjects with schizophrenia (53), depression (50) and normal controls (50) were factoranalyzed in order to test whether processing speed, selective attention and automatic processing comprise distinct aspects of attention and are differentially impaired in the two illnesses. Both clinical groups were impaired in speeded measures, but only the schizophrenic subjects were impaired in selective attention. All performed normal with regard to automatic attention. CPT-results suggested that schizophrenic subjects profited from automatization, while depressed subjects became fatigued. The study indicates that performance decrement on attention tests in depression is due to a non-specific speed reduction consistent with lack of effort. In addition to impaired processing speed, the schizophrenic subjects exposed a deficit in selective attention, indicating executive dysfunction.
Oppmerksomhetsvansker kjennetegner både pasienter med schizofreni og alvorlig depresjon. Spørsmålet er om forskjellige aspekter ved oppmerksomhet svikter på ulikt vis hos disse pasientgruppene. Redusert selektiv oppmerksomhet er særlig fremtredende ved schizofreni, mens redusert prosesseringshastighet og økt trettbarhet kan være typisk for depresjon.
Innledning
Oppmerksomhetsvansker regnes som et fremtredende trekk ved den kognitive svikt som ofte sees hos pasienter med schizofreni (Rund & Borg, 1998). Svikt i oppmerksomhet har også vært funnet hos pasienter med alvorlig depresjon (Mialet, Pope, & Yurgelun-Todd, 1996). Vurdering av konsentrasjonsvansker inngår sågar som ett av ni diagnostiske kjennetegn ved depresjon (American Psychiatric Association, 2000). Et viktig spørsmål er hvorvidt det er forskjeller i oppmerksomhetsvanskene ved schizofreni og depresjon.
I oppmerksomhetsforskningen skilles det gjerne mellom prosesseringstempo, selektiv oppmerksomhet og automatisk oppmerksomhet (Brebion et al., 2000; LaBerge, 1990). I denne studien vil vi undersøke om faktoranalyse av en rekke ulike oppmerksomhetsprøver kan bekrefte gyldigheten av denne teoridrevne inndelingen. Vi spør også om disse ulike aspektene ved oppmerksomhet svikter på ulikt vis hos pasienter med schizofreni og depresjon. Vi har tidligere publisert resultater basert de samme dataene (Egeland et al., 2003). Da foretok vi en a priorisk inndeling av testene etter design og laget tre sammensatte mål. Vi slo sammen testene som presumptivt målte 1) selektiv oppmerksomhet med hastighet som avhengig variabel (god konsentrasjon = kort tid brukt), 2) selektiv oppmerksomhet uten tempokrav (god konsentrasjon = korrekte responser) og 3) hastighet med små oppmerksomhetsmessige krav (godt basalt prosesseringstempo = kort tid brukt). Vi fant at pasienter med schizofreni hadde vansker med alle tre typer tester, mens pasienter med depresjon bare hadde vansker med hastighetstestene. I denne artikkelen presenterer vi resultatene for hver enkelt test, og har gjennom faktoranalyse en empirisk tilnærming til spørsmålet om hvilke tester som kan grupperes sammen.
På gruppenivå har både pasienter med schizofreni og depresjon vansker med alle prøver der avhengig variabel er tid. Denne psykomotoriske retardasjonen sees allerede i enkle reaksjonstidsprøver som måler automatisk prosessering (Mialet et al., 1996; van den Bosch, Rombouts, & van Asma, 1996). Begge grupper er også sene på oppgaver som setter krav til kontrollert prosessering (Brebion et al., 2000). Med kontrollert prosessering menes bevisst seleksjon av relevante stimuli på bekostning av irrelevante stimuli der handlingsimpulsene tvert imot må hemmes. Mens automatisk prosessering er stimulusdrevet, krever selektiv oppmerksomhet eller kontrollert prosessering derimot at automatiske handlingsimpulser overstyres i en «ovenfra og ned»-prosess.
Enkeltstående resultater på tid-takings-tester av selektiv oppmerksomhet, fører ofte til fortolkningsvansker: Gjør klienten det dårlig fordi han/hun har spesifikke vansker med relevant seleksjon og overstyring av automatiske handlingsimpulser, eller gjenspeiler det dårlige resultatet den allmenne psykomotoriske retardasjonen?
For å besvare dette, er det ofte nødvendig å korrigere for basal hastighet i fortolkningen av oppmerksomhetstesten. Et eksempel på en slik type korreksjon er at mange klinikere skjeler til resultatet på Trail-Making Test-A, før de eventuelt fortolker et dårlig resultat på TMT-B som uttrykk for vansker med delt oppmerksomhet.
Stroop-testen (Mitrushina, Boone, & D’Elia, 1999) er et annet eksempel på en prøve som gir klinikeren et redskap for å skille mellom allmenn hastighetsreduksjon og spesifikk svikt i kontrollert prosessering. Testen består av tre oppgaver som varierer fra automatisk til kontrollert prosessering (Stuss, Floden, Alexander, Levine & Katz, 2001). Klienten kan være generelt sen på alle oppgavene. Noen personer er imidlertid senere på prøven som setter krav til selektiv oppmerksomhet (Farge–ord-versjonen) enn man ville forventet utfra nivået på de mer automatiske delprøvene (ordlesing og fargebenevning-versjonene). En slik spesifikk interferenseffekt sees ofte hos pasienter med schizofreni (Schooler, Neumann, Caplan & Roberts, 1997), mens deprimerte pasienter oftere viser seg å være generelt sene (Degl’Innocenti, Ågren, & Bäckman, 1998).
Selektiv oppmerksomhet betraktes vanligvis som et aspekt ved eksekutivfunksjon, og er særlig avhengig av intakt prefrontal hjernefunksjon (Fernandez-Ducque & Posner, 2001). En rekke undersøkelser har vist svikt i eksekutivfunksjoner ved schizofreni (Nathaniel-James et al., 1996), samtidig som billeddiagnostikk har vist prefrontal dysfunksjon (Manoach et al., 2000). Også ved depresjon har flere forskere funnet indikasjoner på prefrontal dysfunksjon, selv om disse funnene ikke er entydige (Elliot, 1998; Stordal et al., 2004).
Ifølge Fernandez-Ducque og Posner (2001) opprettholdes automatisk oppmerksomhet gjennom subkortikale me-kanismer, særlig gjennom aktivering av oppadstigende thalamiske projeksjoner. Mens selektiv og automatisk oppmerksomhet synes knyttet til bestemte anatomiske strukturer, er alment prosesseringstempo vanskeligere å lokalisere. Selv om nedsatt tempo kjennetegner pasienter med frontal skade (Stuss et al., 2001), er hastighetsreduksjon det fremste symptomet også ved diffus encephalopati etter lukket hodeskade (Spikman, van Zomeren & Deelman, 1996) og ved aldring (Salthouse, 2000). Nedsatt prosesseringshastighet kan simpelthen være uttrykk for lav motivasjon, manglende overskudd eller svak evne til anstrengelse. Nettopp dette siste har vært foreslått som en forklaring på kognitiv svikt ved depresjon (Weingartner, 1986). Vanligvis tenker man seg at grad av anstrengelse samvarierer med grad av kontrollert prosessering (Reisberg, 1997). Definisjonsmessig skal jo automatisk prosessering være omkostningsfritt eller uanstrengt, altså skje uten at man fokuserer på oppgaven. Kontrollert oppmerksomhet derimot er viljestyrt og forutsetter at klienten frivillig velger å anstrenge seg. Både spesifikk svikt i evne til seleksjon av relevante stimuli og svikt i evne til anstrengelse, kan således mediere vansker på selektive oppmerksomhetsprøver. Spørsmålet er om sammenligning av hastighet og ikke-hastighetsbaserte prøver kan skille mellom disse to mulige mekanismene. Man kan tenke seg at en «ekte» svikt i evne til seleksjon vil ytre seg i alle oppgaver som krever dette, uavhengig av om de er hastighetsbaserte eller ikke. Alternativt kan man tenke seg at anstrengelsesmediert svikt vil være særlig fremtredende i oppgaver som krever rask respons. I oppgaver som ikke setter krav til raskt tempo, kan man tenke seg at det å avgi riktig respons, ikke er mer anstrengende enn å avgi feil, hvis man først har evnen til å selektere.
Siden svikt i eksekutivfunksjoner synes involvert i schizofreni, vil vi forvente at gruppen av pasienter med schizofreni vil ha vansker med alle prøver som setter krav til selektiv oppmerksomhet. Vi forventer derimot at de deprimerte pasientenes vansker er anstrengelsesutløst, og at de dermed vil prestere bedre på selektive oppmerksomhetsprøver som ikke er hastighetsbaserte og som dermed trolig er mindre anstrengende. Fordi de automatiske oppgavene ikke krever pre-frontalt mediert seleksjon av stimuli, forventer vi at pasientene med schizofreni vil prestere normalt. Fordi den automatiske prosesseringen skjer uanstrengt, forventer vi at de deprimerte pasientene vil prestere normalt på de samme prøvene.
Metode
Deltagerne i prosjektet var 53 pasienter med schizofreni, 50 pasienter med tilbakevendende alvorlig depressiv lidelse (henholdsvis diagnosenummer 295 og 296.3 i DSM-IV) og 50 friske kontroller. De var rekruttert fra følgende sykehus fra slutten av 1998 til våren 2000: Diakonhjemmets Sykehus, Psykiatrisk avd., Vinderen; Bergen Psykiatriske Sykehus, Avd. Haukeland og Sandviken; Aker Universitetssykehus, Klinikk for psykiatri, Gaustad. Kontrollene ble rekruttert etter avisintervju og gjennom spredning av løpesedler i Bergen og Tønsberg.
Diagnose ble satt ved hjelp av The Structured Clinical Interview for DSM-IV Axis 1 Disorders (SCID-I, version 2.0; First, Spitzer, Gibbon, & Williams, 1995) av en av fem psykiatere med lang erfaring i diagnostikk. De vurderte også pasientene med følgende prøver: The Extended Brief Psychiatric Rating Scale (BPRS) (Lukoff, & Ventura, 1986), The Global Assessment of Functioning (GAF), Hamilton Depression Scale (HDS) (Hamilton, 1960), Montgomery-Åsberg Depression Rating Scale (Montgomery-Åsberg, 1979) og The Positive and Negative Syndrome Scale (PANSS) (Kay, Fiszbein, & Opler, 1987). Reliabilitetssjekk av fem utvalgte kasi gjennom skåring fra video-opptak viste ingen uenighet mellom de fem psykiaterne som deltok i diagnostiseringen. Intraklasse-korrelasjonene mellom skårene for symptomskalaene var alle 0.80 eller høyere.
Førtitre av pasientene med schizofreni hadde en paranoid sykdomsutforming, mens de øvrige tilhørte følgende undergrupper: 3 disorganiserte, 1 kataton, 2 residual og 4 udifferensiert form. Depresjonsutvalget besto av 50 personer med alvorlig depressiv lidelse, tilbakevendende form. Fem av deltagerne hadde psykotiske symptomer på undersøkelsestidspunktet. Minimumskåre for inklusjon i depresjonsgruppen var satt til 21 på MADRS og 18 på HDS. Anamnestiske opplysninger om hypomane episoder var eksklusjonsgrunn.
Fire pasienter med schizofreni brukte ikke nevroleptika. Elleve pasienter brukte typiske (tradisjonelle) nevroleptika, mens 36 brukte atypiske (nye) antipsykotiske medikamenter og to deltagere brukte begge typer. Tre schizofrenipasienter brukte medikamenter med kjent anticholinerg virkning.
Alle de deprimerte pasientene med unntak av fire, brukte antidepressiva. Åtteogtyve brukte SSRI-medikasjon, ingen brukte tricykliske antidepressiva. Elleve i depresjonsgruppen sto også på nevroleptika, hovedsakelig som hypnotikum (typiske nevroleptika: 7, atypiske: 3, begge typer: 1).
Trettien av deltagerne var i poliklinisk behandling på undersøkelsestidspunktet, mens 72 var inneliggende. Alle deltagerne var norsktalende, mellom 19 og 51 år gamle, hadde normalt syn og hørsel, og hadde undertegnet skriftlig informert samtykke-erklæring. Eksklusjonskriterier for deltagere i alle tre gruppene var a) utviklingsforstyrrelser, tidligere hodeskade eller tidligere/nåværende nevrologisk sykdom, b) nåværende alkohol-eller stoffmisbruk, c) somatiske sykdommer som kan tenkes å påvirke funksjon i sentralnervesystemet. Kontrollene oppga at de ikke hadde, og ikke tidligere hadde hatt, noen diagnostisert psykisk lidelse.
Demografiske og kliniske opplysninger fremgår av Tabell 1. Det var ingen gruppeforskjeller mht. alder, utdanning og kjønn. IQ ble anslått ut fra resultatene på delprøvene Likheter og Billedutfylling fra WAIS-r (Wechsler, 1981). Pasienter med schizofreni hadde lavere skåre enn de to andre gruppene. Sammenlignet med deprimerte pasienter, hadde schizofrenipasientene også mer patologiske BPRS- og GAF-skårer, hvilket indikerte en mer omfattende psykisk forstyrrelse. Symptomvaliditetstesten Victoria Symptom Validity Test (VSVT; Slick, Hopp, Strauss, & Thompson, 1997) ga ikke holdepunkter for bevisst underytelse hos noen av deltagerne.
Nevropsykologiske mål
Deltagerne gikk gjenom et omfattende nevropsykologisk testbatteri, der følgende tester analyseres i denne artikkelen:
Degraded Stimulus Continuous Performance Test (DS-CPT) version 7.10 (Nuechterlein, 1991). I denne testen av vedvarende oppmerksomhet, skal deltagerne respondere hver gang tallet 0 projiseres på en dataskjerm. Etter to korte treningsrunder startet den tellende delen av prøven, der det ble projisert 480 eksponeringer i form av uklare tall. Tjuefem prosent av eksponeringene var 0’er. Testen varte i 8 minutter. Utfra antall treff og falske positive regnet vi ut signal deteksjonsrate (d’) samt fall i denne raten som en funksjon av tid (d’: siste tredel av prøven sammenlignet med den første tredelen).
Dikotisk lytting (Hugdahl, 1995). To ulike auditive stimuli ble presentert samtidig i begge ører. I den versjonen av DL som vi brukte her (Green, Hugdahl, & Mitchell, 1994), ble vokalen ‘a’ kombinert med en av seks konsonanter. I den frie versjonen av prøven skal klientene si høyt det de hører, mens de i de to tvungne versjoner skal rette oppmerksomheten henholdsvis mot høyre og venstre øre. I frie versjoner av prøven, er det vanlig å finne en høyreøre-dominans (Right Ear Advantage = REA). REA rapporteres både ved den frie betingelsen og ved instruksjon om høyreøre-lytting. Ved instruksjon om venstreøre-lytting oppgis venstreøre-dominans (Left ear advantage = LEA). Mens høyreøre-dominans ved fri lytting er et mål på automatisk prosessering, regnes instruks om høyreøre-lytting som en halv-automatisk oppgave. Deltageren skal kun konsentrere seg om å forsterke den stimulusdrevne handlingstilbøyeligheten. Ved instruks om å rette oppmerksomheten mot venstre øre, må imidlertid deltageren overstyre den naturlige høyreøre-tilbøyeligheten. Venstreøre-dominans i denne betingelsen blir dermed et mål på kontrollert oppmerksomhet.
Tabell 1. Demografiske og kliniske kjennetegn.
Variabel |
Pas. m/schizofreni N = 53 Pas. m/depresjon N = 50 |
Kontroller N = 50 |
Signifikans (Anova eller chi-kvadrat) |
||||
|---|---|---|---|---|---|---|---|
Kjønn (Menn/kvinner) |
33/20 |
21/29 |
25/25 |
|
|
|
?2 (2, N = 153) = 4.30, p = .115 |
Alder |
31.5 |
(8.4) |
35.1 |
(8.7) |
32.9 |
(9.0) |
F(2,150) = 2.17, p = .108 |
Utdanning (år) |
13.3 |
(3.1) |
13.9 |
(2.9) |
13.9 |
(2.5) |
F(2,150) = 0.76, p = .466 |
IQ-estimat |
92.5 |
(11.4) |
101.4 |
(12.3) |
105.0 |
(7.9) |
F(2,146) = 18.41, p <.001 |
VSVT 5 sec % valide* |
95.0 |
|
100.0 |
|
100.0 |
|
?2 (2, N = 133) = 4.24, p = .119 |
År siden sykdomsdebut |
7.3 |
(5.8) |
10.5 |
(8.6) |
|
|
F(1,90) = 4.58, p = .035 |
GAF |
39.7 |
(11.4) |
45.9 |
(8.4) |
|
|
F(1,97) = 9.33, p = .002 |
BPRS |
51.9 |
(16.9) |
43.5 |
(7.3) |
|
|
F(1,100) = 10.48, p = .001 |
MADRS |
13.0 |
(6.3) |
28.5 |
(4.4) |
|
|
F(1,101) = 204.97, p <.001 |
HDRS, Ham-D |
11.1 |
(5.4) |
22.4 |
(4.3) |
|
|
F(1,99) = 127.97, p <.001 |
PANSS |
75.5 |
(23.0) |
57.8 |
(13.5) |
|
|
F(1,101) = 50.04, p <.001 |
Negative symptomer |
21.5 |
(8.4) |
16.5 |
(7.9) |
|
|
F(1,101) = 9.50, p = .002 |
Positive symptomer |
16.6 |
(7.6) |
8.3 |
(3.1) |
|
|
F = (1,101) 50.04, p <.001 |
Stroop. Vi brukte Hugdahls Stroop-test, som er en forkortet utgave av Commali og Kaplans versjon (Mitrushina et al., 1999). Seks fargenavn (hvit, svart, rød, blå, grønn og gul) eller fargeklatter med tilsvarende farge, ble gjengitt til sammen 48 ganger. I de to kongruente delprøvene skal deltageren først benevne fargeklattene, og i neste oppgave lese den enkle teksten som er skrevet med svart blekk på hvit bunn. I den inkongruente versjonen er det uoverensstemmelse mellom blekkfarge og tekst. Deltageren skal benevne blekkfargen og undertrykke den automatiske impulsen om å lese i stedet. Målene vi oppgir her er antall sekunder klienten bruker på å gjennomføre hver prøve. I tillegg har vi regnet ut en interferensskåre etter modell fra Goldens (1978) Stroop-versjon. Basert på tiden det tar å lese et ord og benevne en farge, beregnes en predikert farge–ord-skåre. Forskjellen mellom predikert og observert skåre gir et mål på eventuelle vansker med selektiv oppmerksomhet.
Fra California Computerized Assessment Package (CalCAP) (Miller, 1993) valgte vi ut fire delprøver som målte enkel reaksjonstid og gradvis mer krevende selektiv reaksjonstid. I den enkle reaksjonstidstesten bes deltageren simpelthen om å trykke på tastaturet hver gang et 1-tall dukket opp på dataskjermen. I neste oppgave («Choice reaction time»), skal deltageren kun respondere på 7-tall. Tilslutt følger to sekvensielle oppgaver der deltageren henholdsvis skal respondere ovenfor to like tall etter hverandre, og når neste tall er i stigende rekkefølge. Oppgavene representerer et kontinuum fra automatisk til mer komplisert informasjonsprosessering.
Data-analyser
Vi gjennomførte først en multivariat variansanalyse (MANOVA) og fire variansanalyser for gjentatte mål («repeated measures analysis of variance»: diagnosegruppe x individuelle deltest-skårer for hver av de fire testene). Funn av gruppeforskjeller vil da indikere at en gruppe generelt er svakere/bedre enn en annen. Funn av interaksjoner vil indikere et mulig utfall på et bestemt aspekt i oppmerksomhet. Oppfølgingsanalyser ble gjort med ANOVAs og post-hoc analyser (LSD) med signifikansnivå < 05. Interaksjoner mellom gruppe og deltestskårer ble videre analysert med t-tester.
Faktoranalyse ble gjennomført med varimax-rotasjon. For å redusere antall variabler ble kun den første og fjerde delprøven valgt ut fra CalCAP. I tillegg til delprøveskårene på Stroop, inngikk også interferensmålet i analysen. I stedet for å legge inn skårer fra hver tredel i CPT, ble det lagt inn en samleskåre (Total signal deteksjon d’) og et mål for endring fra første til siste tredel (? d’). Fem av deltakerne manglet skårer på en test. Gruppegjennomsnittet for personens respektive diagnosegruppe ble da brukt i stedet.
Resultater
Tabell 2 viser råskårer for de enkelte deltester. Figur 1a-d viser de kliniske gruppenes prestasjoner som avvikskårer (z-skårer) beregnet utfra skårene til kontrollene.
Tabell 2. Testresultater for personer med schizofreni (n = 53), depresjon (n = 50) og kontroller (n = 50).
|
Pas. m/schizofreni |
Pas. m/depresjon |
Kontroller |
ANOVA |
|
|
||||
|---|---|---|---|---|---|---|---|---|---|---|
DS-CPT | ||||||||||
1 d’ |
2.24 |
(.98) |
2.53 |
(.89) |
2.82 |
(.95) |
4.83 |
2,145 |
.009 |
S<K |
2 d’ |
2.30 |
(.95) |
2.47 |
(.84) |
2.79 |
(1.07) |
3.49 |
2,145 |
.033 |
S<K |
3 d’ |
2.27 |
(.88) |
2.16 |
(.91) |
2.60 |
(.88) |
3.02 |
2,145 |
.051 |
D<K |
Samlet d’ |
2.25 |
(.82) |
2.34 |
(.81) |
2.69 |
(.92) |
3.66 |
2,145 |
.028 |
S<K |
?d’ |
0.04 |
(.78) |
-0.36 |
(.74) |
-0.22 |
(.66) |
3.91 |
2,145 |
.022 |
D<S |
Dikotisk lytting | ||||||||||
Fri versjon, REA2 |
56.58 |
(12.45) |
55.53 |
(15.18) |
55.61 |
(16.30) |
0.02 |
2,148 |
.978 |
n.s. |
FR-REA2 |
68.39 |
(12.36) |
68.80 |
(17.01) |
71.23 |
(14.36) |
0.94 |
2,148 |
.390 |
n.s |
FL-LEA2 |
43.26 |
(14.72) |
55.50 |
(19.83) |
53.59 |
(17.68) |
6.49 |
2,148 |
.002 |
S<,K |
STROOP |
|
|
|
|
|
|
|
|
|
|
Ordlesing3 |
20.88 |
(7.05) |
19.42 |
(5.57) |
16.54 |
(3.11) |
8.11 |
2,149 |
<.001 |
S,D<K |
Fargebeneving3 |
32.84 |
(11.00) |
29.88 |
(6.42) |
25.54 |
(5.05) |
10.82 |
2,149 |
<.001 |
S,D<K |
Farge–Ord3 |
61.36 |
(23.25) |
53.54 |
(13.45) |
43.72 |
(9.56) |
14.48 |
2,149 |
<.001 |
S<D<K |
Interferens4 |
7.80 |
(15.22) |
4.24 |
(10.84) |
1.64 |
(6.36) |
3.71 |
2,149 |
.027 |
S<K |
Calcap 5 | ||||||||||
Enkel reaksjonstid |
356.15 |
(93.80) |
365.87 |
(84.82) |
311.45 |
(68.03) |
5.90 |
2,145 |
.003 |
S,D<K |
Valg-reaksjonstid |
465.58 |
(86.43) |
454.00 |
(92.83) |
413.95 |
(55.04) |
5.60 |
2,145 |
.004 |
S<K |
Sekvensiell reaksjonstid1 |
612.78 |
(115.17) |
566.75 |
(109.41) |
507.62 |
(98.93) |
11.71 |
2,145 |
<.001 |
S,D<K |
Sekvensiell reaksjonstid2 |
696.70 |
(119.42) |
638.30 |
(137.22) |
572.93 |
(111.15) |
12.49 |
2,145 |
<.001 |
S,D<K |
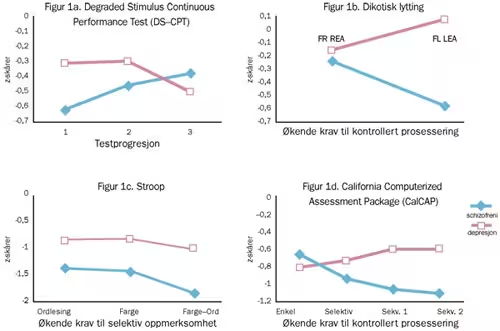
Figur 1. Testprofil for personer med schizofreni (n = 53) og depresjon (n = 50). Figuren viser z-skårer basert på kontrollpersonenes (n = 50) resultater.
DS-CPT
Variansanalyse for gjentatte målinger viste både en statistisk signifikant effekt av diagnose (F(2,145) = 3.93, p = .022) og en interaksjon mellom diagnose og skåre på de tre tredjedelene av prøven (F = 3.70, p = .027). Oppfølgingsanalyser viste at schizofrene pasienter hadde lavere signaldeteksjon (d’) enn kontroller når prøven sees under ett. Når tredelene analyseres hver for seg, presterte de schizofrene pasientene kun svakere enn kontrollene på de første to tredelene. De depressive pasientene og kontrollene viste en statistisk signifikant nedgang i prestasjoner fra første til tredje tredel (depressive: t(47) = 3.40, p = .001; kontroller: t(46) = 2.25, p = .029).
Figur 1a illustrerer interaksjonen mellom tredel og gruppetilhørighet: Til å begynne med presterer de depressive bedre enn de schizofrene pasientene, men i siste tredel er denne forskjellen reversert.
Dikotisk lytting
Det var en statistisk signifikant forskjell mellom diagnosegruppene (F(2,147) = 5.97, p = .003) og mellom betingelsene (F(2,294) = 50.30, p < .001). Sammenligning av bare de to kliniske gruppene, viste også en statistisk signifikant interaksjon (F = (1, 98) 4.94, p = .029). De schizofrene pasientene presterte svakere enn de depressive og kontrollene med hensyn til å modulere oppmerksomhet mot venstre øre (FL LEA). Det var ikke gruppeforskjeller i forhold til å modulere oppmerksomhet mot høyre øre (FR REA). Interaksjonen mellom depresjonspasientene og schizofrenipasientene il-lustreres i Figur 1b: Ved automatisk prosessering presterer de likt. Ved økende krav om kontrollert oppmerksomhet blir de schizofrenipasientene dårligere, mens depresjonspasientene faktisk presterer relativt sett noe bedre.
Stroop
Det ble funnet statistisk signifikante gruppeforskjeller (F = (2, 148) 15.22, p < .001), forskjeller mellom subtester (F = (2, 148) 688.77, p < .001) og en interaksjon mellom subtest og gruppetilhørighet (F = (2, 148) 9.42, p < .001). Begge de kliniske gruppene presterte svakere enn kontrollene på alle tre deltestene. Schizofrenipasientene presterte svakere enn depresjonspasientene på farge–ord-delprøven som målte selektiv oppmerksomhet (Se fremstilling i z-skårer i Figur 1c, samt absolutte skårer i Tabell 2). Kovariansanalyse viste at pasientene med schizofreni presterte dårligere enn kontrollene på CW-prøven selv når forskjeller i lesetempo og benevningstempo var kontrollert for (ANCOVA: F = (3, 97) 5.09, p = .026). Bare schizofrenipasientene var statistisk signifikant forskjellig fra kontrollene på Goldens Stroop-interferens-mål.
CalCAP
Både forskjeller mellom diagnosegrupper (F(2,145) = 13.26, p < .001) og delprøve (F(3,435) = 498.78, p < .001) var statistisk signifikante. Det ble også funnet en interaksjonseffekt mellom gruppe og delprøve (F(6,435) = 4.45, p <.001), som illustreres i Figur 1d ved at linjene for de to kliniske gruppene krysser hverandre. Begge kliniske grupper presterte imidlertid forskjellig fra kontrollene på alle fire delprøver. Pasientene med schizofreni presterte svakere enn de med depresjon på den mest kompliserte sekvensielle delprøven (Sekv. 2). Schizofrenigruppens særlige svikt på Sekv. 2 forble statistisk signifikant når vi korrigerte for virkningen av lavt basalt tempo (enkel reaksjonstid) (sammenligning med kontroller: ANCOVA: F = (2, 96) 20.78, p < .001; sammenlignet med pasientene med depresjon: F = (2, 97) 7.03, p = .009). Forskjellen mellom kontrollene og de depressive pasientene på Sekv. 2, var imidlertid ikke lenger signifikant når vi kontrollerte for enkel reaksjonstid.
Tabell 3. Faktorstruktur og struktur for oppmerksomhetstester av personer med schizofreni (n = 53), depresjon (n = 50) og friske kontroller (n = 50).
|
Kommunalitet |
F1 |
F2 |
F3 |
|---|---|---|---|---|
CalCAP: |
|
|
|
|
SRT |
.49 |
.63 |
|
35 |
SRT2 |
.49 |
.59 |
|
|
Dikotisk lytting: |
|
|
|
|
FR REA |
.41 |
|
|
.74 |
FL LEA |
.57 |
|
-.62 |
|
Stroop: |
|
|
|
|
Ordlesing |
.77 |
.87 |
|
|
Fargebenevning |
.76 |
.86 |
|
|
Farge–Ord |
.85 |
.74 |
.55 |
|
Interferens |
.70 |
|
.83 |
|
DS-CPT: |
|
|
|
|
Signaldeteksjon |
.38 |
|
.57 |
|
Endring over tid |
.46 |
|
|
.67 |
Faktoranalysen
Varimax rotasjon ga tre faktorer (Tabell 3) med eigenverdier på henholdsvis 2.93, 1.48 og 1.09. De tre faktorene forklarte 57.3 % av den totale variansen. Den første faktoren ladet på alle hastighetsprøvene, og forklarte 29.8 % av variansen. Den neste faktoren forklarte 14.2 % av variansen, og ladet på de ikke-tempoavhengige målene på selektiv oppmerksomhet, det vil si Stroop interferens, CPT signal deteksjon d’ og dikotisk lytting FL LEA. Den tredje faktoren forklarte 13.2 % varians, og ladet på dikotisk lytting FR REA, enkel reaksjonstid fra Calcap og forbedring av skårene over tid på CPT. Etter vår vurdering lader denne faktoren på automatisk prosessering. Vi vil i diskusjonsdelen begrunne dette.
Begge kliniske grupper var forskjellige fra kontrollene med hensyn til hastighetsfaktoren (F(2,136) = 11.97, p <.001). Schizofrenipasientene var forskjellig fra både depresjonspasientene og kontrollene i forhold til selektiv oppmerksomhetsfaktoren (F(2,136) = 6.03, p = .003), mens det ikke var noen gruppeforskjell med hensyn til faktoren som målte automatisk prosessering.
For ytterligere å kartlegge sammenhengen mellom psykiske symptomer og de tre faktorene, ble alle deltagere gitt en faktorskåre som anga korrelasjonen mellom deres testskårer og faktoren. Faktorskårene for schizofrenipasientene ble korrelert med BPRS-skåre, PANSS-skåre og summen av positive og negative symptomer fra PANSS. Internt i schizofrenigruppen var det ingen sammenheng mellom temporeduksjon og noen av disse målene. Det var en korrelasjon mellom svikt i selektiv oppmerksomhet (Faktor 2) og BPRS (Pearsons r = .38, p = .010), PANNS (R = .36, p = .015). Av subskalaene på PANSS korrelerte bare positive symptomer alene med Faktor 2 (R = .37, p = .007).
Faktorskårer hos pasienter med dep-resjon ble korrelert med BPRS og de to depresjonsskalaene, samt de enkelte ledd på MADRS. Internt i depresjonsgruppen fremkom ingen korrelasjoner mellom faktorene og samleskårene på depresjonsskalaene. Det var imidlertid en korrelasjon mellom automatisk prosessering og opplevde konsentrasjonsvansker (ledd nr. 6 på MADRS) (R = .30, p = .046). Denne korrelasjonen skyldtes primært en sterk sammenheng mellom fallende prestasjon i CPT og opplevd konsentrasjonssvikt (R = .40, p = .004).
Medikasjonseffekter
Det var ingen forskjell mellom umedisinerte og medisinerte pasienter på noen test (analysene ble foretatt for hver klinisk gruppe for seg). Det var heller ingen forskjell mellom klienter med typiske vs. atypiske nevroleptika, eller mellom SSRI og annen type antidepressiva.
Diskusjon
Oppmerksomhetsprøvene grupperte seg i tre faktorer, som ladet på allmenn prosesseringshastighet, selektiv oppmerksomhet og automatisk prosessering. Schizofrenigruppen var sen og hadde også vansker med selektering av relevant informasjon, mens gruppen med depresjon bare fremsto med generelt nedsatt hastighet. Begge kliniske grupper presterte normalt i forhold til automatisk prosessering.
At begge de kliniske gruppene hadde et redusert psykomotorisk tempo er i tråd med tidligere funn (Mialet, Pope & Yurgelun-Todd, 1996; van den Bosch, Rombouts & van Asma, 1996). At schizofrenipasienter har vansker med selektiv oppmerksomhet er også i tråd med tidligere funn når det gjelder Stroop (Hepp, Maier, Hermle, & Spitzer, 1996; Schooler et al., 1997), CPT (Nuecherlein, 1991; Trichard et al., 1995) og dikotisk lytting (Green et al., 1994). Men at vi ikke finner utfall på de selektive oppmerksomhetstestene på depresjonspasienter, strider mot den vanlige antakelsen om konsentrasjonsvansker ved depresjon. Etter vår vurdering er denne antagelsen basert på en for enkel oppmerksomhetsmodell, der det ikke skilles godt nok mellom prosesseringshastighet på den ene siden, og evne til å selektere relevante stimuli og motstå distraksjon, på den andre. Umiddelbart kan virkningen være lik, dvs. at klienten opplever at hun/han ikke får med seg det som skjer rundt seg. De pedagogiske implikasjoner av lav prosesseringshastighet vil imidlertid kunne være forskjellige fra vansker med å selektere stimuli. I det førstnevnte tilfellet vil det mest nærliggende være å redusere presentasjonstempoet i oppgaver, i det sistnevnte vil vi søke å redusere kilder til distraksjon. Faktoranalysen gir validitet til antagelsen av uavhengighet av prosesseringshastighet og selektiv oppmerksomhet. Alle prøver med tid som avhengig variabel, ladet på den samme faktoren, uavhengig av om de var enkle stimulusdrevne reaksjonstidsprøver eller meget krevende selektive oppmerksomhetsoppgaver slik som Stroop Farge–Ord. Alle ikke-hastighetsbaserte oppmerksomhetsmål ladet på den andre faktoren, som vi dermed har kalt for selektiv-oppmerksomhetsfaktoren.
Våre funn om at redusert selektiv oppmerksomhet kjennetegner schizofreni, men ikke depresjon, har implikasjoner for forståelse av de to tilstandenes nevropatologi
Våre funn om at redusert selektiv oppmerksomhet kjennetegner schizofreni, men ikke depresjon, har implikasjoner for forståelse av de to tilstandenes nevropatologi. Mens funnene indikerer frontal dysfunksjon ved schizofreni, vil vi hevde at funnene gir grunn til å tone ned betydningen av frontal dysfunksjon ved depresjon. Vi skal nedenfor utlede argumentene for denne slutningen noe grundigere.
Som nevnt innledningsvis, er selektiv oppmerksomhet et aspekt ved eksekutivfunksjonen, som igjen synes særlig sensitiv for prefrontal hjernedysfunksjon. At vi finner kognitive vansker som indikerer prefrontal dysfunksjon hos schizofrene pasienter, er ikke overraskende. Funksjonell billeddiagnostikk har tidligere vist dysfunksjon i den fremre delen av hjernen hos pasienter med schizofreni (Hugdahl et al., 2000; Manoach et al., 2000).
Innledningsvis formulerte vi en forventning om at pasienter med schizofreni ville vise en gjennomgående svikt i selektiv oppmerksomhet, mens automatisk prosessering som ikke er prefrontalt mediert, ville være normal. Denne forventningen slo altså til.
Tradisjonelt har man tenkt at kontrollert oppmerksomhet er mer anstrengende enn automatisk oppmerksomhet som er mentalt omkostningsfritt (Reisberg, 1997). Selv om det er anstrengende å konsentrere seg, vil nok mange hevde at det også er anstrengende å opprettholde et raskt prosesseringstempo overfor rutineoppgaver! Resonnementet illustrerer at selv om det vanligvis er sammenfall mellom de prosesser vi refererer til med begrepene anstrengende og kontrollert prosessering, er begrepene ikke synonyme. Vi formulerte innledningsvis en forventning om at depresjonspasientenes oppmerksomhetsvansker bedre kunne beskrives som utløst av anstrengelsesvansker enn som å skyldes svikt i kontrollert oppmerksomhet. Følgende forhold gjør at anstrengelseshypotesen passer bedre enn eksekutivfunksjonshypotesen når det gjelder de deprimerte pasientene:
1. Hastighet forklarer mer enn eksekutivfunksjonssvikt: Vi forutsetter at oppgaver med krav om rask reaksjon er mer anstrengende enn prøver som ikke setter tempokrav. Hvis vanskene skyldtes svikt i eksekutivfunksjonen, burde vi funnet en gjennomgående svikt i alle prøver, ikke kun de som var hastighetsbaserte. Hvis vanskene skyldtes svikt i eksekutivfunksjonen, ville vi ikke forvente at tempoet var redusert også i enkle prøver som ikke satte krav til seleksjon av stimuli/hemming av impulser.
2. Utholdenhetsmålet på CPT: En kan tenke seg at pasienter som har vansker med å selektere relevante stimuli (men som vet hva de skal prøve å oppnå, og er motivert for oppgaven), kan bli noe bedre etter hvert som de får trent på oppgaven. Motsatt kan en tenke seg at pasienter som greier selve seleksjonsprosessen, men som raskere blir trette/mister motivasjonen, vil gjøre det dårligere etter hvert som testen krever ytterligere anstrengelse. Det er nettopp dette som skjer i CPT. Mens pasientene med schizofreni opprettholder samme nivå gjennom testen, greier ikke depresjonspasientene å opprettholde sitt initiale funksjonsnivå på CPT utover i prøven. Relativt sett viser pasientene med depresjon en forhøyet trettbarhet. Depresjonspasientenes fall i prestasjon gjennom testen var imidlertid ikke statistisk signifikant forskjellig fra kontrollene. Sammenligning av de tre gruppene på hver tredel av testen, viste likevel at depresjonspasientene var statistisk signifikant svakere enn kontrollene på den siste tredelen av testen. I den grad de deprimerte fremstår med oppmerksomhetsvansker på CPT, er det på slutten av prøven.
Det synes dermed sannsynlig at trettbarhet medierer svak prestasjon på CPT for depresjonspasientene, mens svikt i selektiv oppmerksomhet medierer svikt hos pasientene med schizofreni.
I denne sammenheng er det verd å merke seg korrelasjonen mellom konsentrasjonsleddet på MADRS og trettbarhet. Dette kan forstås som at deprimerte pasienters opplevelse av konsentrasjonssvikt egentlig dreier seg om økt trettbarhet og manglende evne til anstrengelse. At det ikke er noen sammenheng mellom svikt i selektiv oppmerksomhet og opplevd konsentrasjonssvikt, skyldes kanskje at slike nevropsykologiske fenomener er mindre tilgjengelige for introspeksjon.
Metodekritikk
Til slutt en vurdering av styrke og svakheter ved undersøkelsen. Det styrker undersøkelsen at oppmerksomhet undersøkes med et bredt batteri der testene varierer i forhold til sansemodalitet i stimulus-situasjonene (visuell og auditiv stimulering), og med hensyn til respons (verbalt og motorisk). En mulig innvending mot resultatene i undersøkelsen, er at schizofrenipasientene både var sykere (mer symptombelastet) og svakere intellektuelt enn de deprimerte deltagerne.
Kan det tenkes at hastighets- og oppmerksomhetsreduksjonen egentlig ikke hadde sammenheng med hvorvidt pasientene hadde den ene eller andre lidelsen, men snarere grad av symptomatologi og IQ-nivå? I den engelskspråklige artikkelen basert på disse testene (Egeland et al., 2003) har vi kontrollert for forskjeller i symptomtrykk (GAF, BPRS) uten at det endret på forskjellen i selektiv oppmerksomhet mellom de to kliniske gruppene. Selv om det er en korrelasjon mellom intellektuell funksjon og tempo, har vi ikke kovariert IQ. Dette fordi lav IQ ikke betraktes å forårsake lavt tempo. Derimot kan det motsatte gjerne være tilfelle, nemlig at lavt tempo medierer noe av IQ-reduksjonen. Nebes et al. (2000) fant dette hos et utvalg av eldre pasienter med depresjon. Å kontrollere for IQ ville i såfall øke risikoen for Type II-feil, dvs. at vi feilaktig slutter at det ikke er en sammenheng mellom hastighet og diagnose der det faktisk er det.
Vi fant ingen sammenheng mellom faktorskårer og medikasjon. Medikasjonen var imidertid forskrevet ut fra klinisk tilstand, noe som kan maskere eventuelle effekter. Innenfor fagfeltet er det likevel en økende konsensus om at moderne antidepressiva og nevroleptika ikke har noen vesentlig negativ virkning på kognisjon (Elliot, 1998; Rund, 1999).
Konklusjon
Faktoranalysen viser at den teoridrevne subklassifikasjon av tempo, selektiv oppmerksomhet og automatisk oppmerksomhet som ulike aspekter ved oppmerksomhet er valid. Mens en generell hastighetsreduksjon kjennetegner både depresjon og schizofreni, gir undersøkelsen støtte for at en genuin svikt i selektiv oppmerksomhet primært kjennetegner schizofreni. Begge kliniske grupper presterte normalt for automatisk oppmerksomhet, men det fremkom innenfor denne faktoren indikasjoner på at de kliniske gruppene var forskjellige med hensyn til utholdenhet: Mens schizofrenipasientene ble bedre, muligens takket være automatisering, ble depresjonspasientene dårligere, trolig grunnet økt trettbarhet.
Referanser
American Psychiatric Association (2000). Diagnostic and statistical manual of mental disorders fourth edition, text revision (DSM IV-TR), Washington, DC: Author.
Brebion, G., Smith, M. J., Gorman, J. M., Malaspina, D., Sharif, Z., & Amador, X. (2000). Memory and schizophrenia: Differential link of processing speed and selective attention with two levels of encoding. Journal of Psychiatric Research, 34, 121–127.
Degl’Innocenti, A., Ågren, H., & Bäckman, L. (1998). Executive function in major depression. Acta Psychiatrica Scandinavica, 97, 182?188.
Egeland, J., Rund, B. R., Sundet, K., Landrø, N. I., Asbjørnsen, A., Lund, A., Roness, A., Stordal, K. I., & Hugdahl, K. (2003) Attention profile in schizophrenia compared to depression: Differential effects of processing speed, selective attention and vigilance. Acta Psychiatrica Scandinavica, 108, 276–284.
Elliot, R. (1998). The neuropsychological profile in unipolar depression. Trends in Cognitive Sciences, 2, 447?454.
Fernandez-Ducque, D., & Posner, M. I. (2001). Brain imaging of attentional networks in normal and pathological states. Journal of Clinical & Experimental Neuropsychology, 23, 74?93.
First, M. B., Spitzer, R. L., Gibbon, M., & Williams J. B. W. (1995). Structured clinical interview for DSM-IV axis I disorders-patient edition (SCID I/P, version 2.0). New York State Psychiatric Institute: Biometrics Research Department.
Golden, C. J. (1978). Stroop color and word test. Manual, Odessa, FL: Psychological Assessment Resources.
Green, M. F., Hugdahl, K., & Mitchell, S. (1994). Dichotic listening during auditory hallucinations in patients with schizophrenia. American Journal of Psychiatry, 151, 357?362.
Hamilton, M. (1960). A rating scale for depression. Journal of Neurology, Neuro-surgery & Psychiatry, 23, 56?62.
Hepp, H. H., Maier, S., Hermle, L., & Spitzer, R. L. (1996). The Stroop effect in schizophrenic patients. Schizophrenia Research, 22, 187?95.
Hugdahl, K. (1995). Dichotic listening: Probing temporal lobe functional integrity. I R. J. Davidson & K. Hugdahl (Eds.), Brain assymetry (ss. 123–156), Cambridge, MA: MIT Press.
Hugdahl, K., Rund, B. R., Lund, A., Landrø, N. I., Sundet, K., Ersland, L., Smievoll, A. I., Lundervold, A., Thomsen, T., Roness, A., Stordal, K., Egeland, J., Mjellem, N., Sundberg, H., & Asbjørnsen, A. (2000). Arbeidshukommelse ved schizofreni. En fMRI undersøkelse av nevronale korrelat. Nordisk Psykologi, 52, 277?293.
Kay, S. R., Fiszbein, A., & Opler, L. A. (1987). The Positive and Negative Syndrome Scale for schizophrenia. Schizophrenia Bulletin, 13, 261?276.
LaBerge, D. (1990). Attention. Psychological Science, 1, 156?162.
Lukoff, D. N. K. H., & Ventura D. (1986). Manual for the expanded BPRS. Symptom monitoring in the rehabilitation of schizophrenic patients. Schizophrenia Bulletin, 12, 594?602.
Manoach, D. S., Gollub, R. L., Benson, E. S, Searl, M. M., Goff, D. C., Halpern, E., Saper, C. B., & Rauch, S. L. (2000). Schizophrenic subjects show aberrant fMRI activation of dorsolateral freprontal cortex and basal ganglia during working memory performance. Biological Psychiatry, 48, 99?109.
Mialet, J. P., Pope, H. G., & Yurgelun-Todd, D. (1996). Impaired attention in depressive states: A non-specific deficit? Psychological Medicine, 26, 1009?1020.
Miller, E. N. (1993). Calcap: California Computerized Assessment Package Manual (rev. 4.0). Los Angeles, CA: Eric N. Miller, PhD. and Norland Software.
Mitrushina, M. N.,Boone, K. B., & D’Elia, L. F. (1999). Handbook of normative data for neuropsychological assessment. New York: Oxford University Press.
Montgomery, S. A., & Åsberg, M. (1979). A new depression scale designed to be sensitive to change. British Journal of Psychiatry, 134, 382?389.
Nathaniel-James, D. A, Brown, R., & Ron, M. A. (1996). Memory impairment in schizophrenia: it’s relationship to executive function. Schizophrenia Research, 21, 85?96.
Nebes, R. D., Butters, M. A., Mulsant, B. H., Pollock, B. G., Zmuda, M. D., Houck, P. R., & Reynolds III, C. F. (2000). Decreased working memory and processing speed mediate cognitive impairment in geriatric depression. Psychological Medicine, 30, 679?691.
Nuechterlein, K. H. (1991). Vigilance in schizophrenia and related disorders. Neuropsychology, psychophysiology, and information processing. I H. A. Nasrallah (Ed.), Handboook of schizophrenia, Vol. 5 (ss. 397?433). Amsterdam: Elsevier.
Reisberg, D. (1997). Cognition. Exploring the science of the mind. New York: Norton & Co.
Rund, B. R. (1999). How do neuroleptics affect cognitive dysfunctions in schizophrenia? Nordic Journal of Psychiatry, 53, 121?125.
Rund, B. R., & Borg, N. (1998). Cognitive deficits and cognitive training in schizophrenic patients: A review. Acta Psychiatrica Scandinavica, 100, 85?95.
Salthouse, T. A. (2000). Aging and measures of processing speed. Biological Psychiatry, 54, 35?54.
Schooler, C., Neumann, E., Caplan, L. J., & Roberts, B. R. (1997). A time course analysis of Stroop interference and facilitation: Comparing normal individuals and individuals with schizophrenia. Journal of Experimental Psychology: General, 126, 19?36.
Slick, D., Hopp, G., Strauss, E. J., & Thompson, G. B. (1997). Victoria Symptom Validity Test- version 1.0 Professional Manual. Odessa, Fl.: Psychological Assessment Resources.
Spikman, J. M., van Zomeren, A. H., & Deeelman, B. G. (1996). Deficits of attention after closed-head injury: Slowness only? Journal of Clinical & Experimental Neuropsychology, 18, 755?767.
Stordal, K., Lundervold, A. J., Egeland, J., Mykletun, A., Asbjørnsen, A., Hugdahl, K., Landrø, N. I., Roness, A., Rund, B. R., Sundet, K., Ødegaard, K. J. & Lund, A. (2003). Mild impairment in cognitive functions in major depressive disorder. Nordic Journal of Psychiatry, 58, 41–47.
Stuss, D. T., Floden, D., Alexander, M. P., Levine, B., & Katz, D. (2001). Stroop performance in focal lesion patients: dissociation of processes and frontal lobe lesion location. Neuropsychologia, 39, 771?786.
Trichard, C., Martinot, J. L., Alagille, M., Masure, M. C., Hardy, P., Ginestet, D., & Feline, A. (1995). Time course of prefrontal lobe dysfunction in severely depressed in-patients: A longitudinal neuropsyhological study. Psychological Medicine, 25, 79?86.
van den Bosch, R., Rombouts, R.P., & van Asma, M. J. O. (1996). What determines continuous performance task performance? Schizophrenia Bulletin, 22, 543?561.
Wechsler, D. (1981) Wechsler Adult Intelligence Scale-Revised. New York: the Psychological Corporation.
Weingartner, H. (1986). Automatic and effortdemanding cognitive processes in depression. I L. W. Poon (Ed.), Clinical memory assessment of older adults (ss. 218?225). Washington, DC: American Psychological Association.
